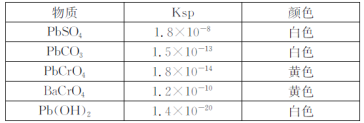
-
化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
A.用石材制作砚台的过程是化学变化
B.氯化铵溶液可清除铜制品表面的锈渍,是因为氨根离子水解使溶液显酸性
C.月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
难度: 中等查看答案及解析
-
通常检测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.生成2.33gBaSO4沉淀时,转移电子数目为0.02NA
B.SO2具有漂白性,从而可使品红褪色
C.17gH2O2中含有非极性键的数目为0.5NA
D.0.1molBaCl2晶体中所含分子总数为0.1NA
难度: 中等查看答案及解析
-
下列事实不能说明X元素的非金属性比硫元素的非金属性强的是( )
A.X单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molX单质比1mol硫得电子多
C.X和硫两元素的气态氢化物受热分解,前者的分解温度高
D.X元素的最高价含氧酸的酸性强于硫酸的酸性
难度: 中等查看答案及解析
-
某同学结合所学知识探究Na2O2与H2能否反应,设计装置如图,下列说法正确的是( )
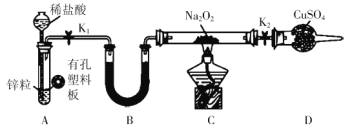
A.装置A中锌粒可用铁粉代替
B.装置B中盛放碱石灰,目的是除去A中挥发出来的少量水蒸气
C.装置C加热前,必须先用试管在干燥管管口处收集气体,检验气体纯度
D.装置A也可直接用于MnO2与浓盐酸反应制取Cl2
难度: 中等查看答案及解析
-
普通电解精炼铜的方法所制备的铜中仍含杂质,利用如图中的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是( )
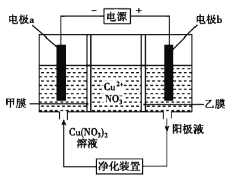
A.电极a为粗铜
B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区
D.当电路中通过1mol电子时,可生成32g精铜
难度: 中等查看答案及解析
-
已知:CH3C≡CH+CO+CH3OH
M,N+CH3OH
M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是( )
A.N可以使溴水褪色
B.N转化为M的反应为取代反应
C.M中所有碳原子可能共面
D.N属于酯的同分异构体有3种
难度: 中等查看答案及解析
-
常温下,下列有关溶液的说法正确的是( )
A.pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液:NH4+浓度的大小顺序为①>②>③
B.常温下,pH为5的氯化铵溶液和pH为5的醋酸溶液中水的电离程度相同
C.HA的电离常数Ka=4.93×10-10,则等浓度的NaA、HA混合溶液中:c(Na+)>c(HA)>c(A-)
D.已知在相同条件下酸性HF>CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-)
难度: 中等查看答案及解析