-
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )
A.自来水厂常用明矾作消毒杀菌剂
B.高铁车用大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点
C.硅胶可作瓶装药品的干燥剂及催化剂载体,也是重要的半导体材料
D.使用肥皂洗手可预防病毒,肥皂的主要成分硬脂酸钠溶于水显酸性
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是()
A.常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中阳离子的数目相等
B.标准状况下,22.4LHF所含有的分子数目为NA
C.常温常压下,NO2与N2O4的混合气体46g,原子总数为3NA
D.0.1mol-NH2(氨基)中所含有的电子数为NA
难度: 简单查看答案及解析
-
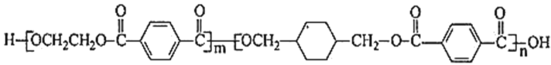
某有机物的结构简式如图所示。下列关于该有机物的说法正确的是( )
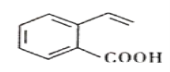
A.该有机物能发生酯化、加成、氧化、水解等反应
B.该有机物中所有碳原子不可能处于同一平面上
C.与该有机物具有相同官能团的同分异构体有3种
D.1mol该有机物最多与4molH2反应
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次递增。X和Z形成的化合物的水溶液呈中性,W和X的最外层电子数之和等于Z的最外层电子数,同一主族的W和Y,Y的原子序数是W的2倍,下列说法不正确的是( )
A.原子半径:W<Z<Y<X
B.Y的气态氢化物的稳定性弱于Z的气态氢化物
C.W与X形成的化合物不可能含有共价键
D.常温常压下,Y的单质是固态
难度: 中等查看答案及解析
-
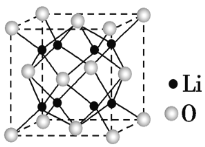
某种钴酸锂电池的电解质为LiPF6,放电过程反应式为xLi+L1-xCoO2=LiCoO2。工作原理如图所示,下列说法正确的是( )
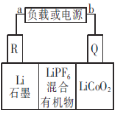
A.放电时,正极反应式为xLi++Li1-xCoO2+xe-=LiCoO2
B.放电时,电子由R极流出,经电解质流向Q极
C.充电时,R极净增14g时转移1 mol电子
D.充电时,Q极为阴极
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作和现象
预期实验目的或结论
A
用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色
说明该食盐试样不含KIO3
B
SiO2能与氢氟酸及碱反应
SiO2是两性氧化物
C
向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀
KI3溶液中存在平衡:
I2+I-
D
室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液
除去杂质FeCl3得纯净CuCl2溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
298K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO−的浓度存在关系式c(HCOO−)+c(HCOOH)=0.100mol·L−1,而含碳元素的粒子的浓度与pH的关系如图所示:
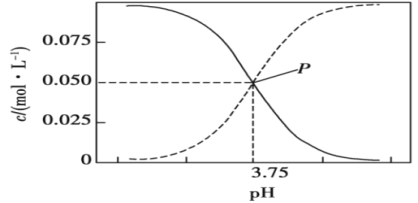
下列说法正确的是( )
A.0.1mol·L−1HCOONa溶液中有c(HCOO−)+c(HCOOH)+c(OH−)=c(H+)+0.1
B.298K时,HCOOH的电离常数Ka=1.0×10−3.75
C.298K时,加蒸馏水稀释P点溶液,溶液中n(H+)·n(OH−)保持不变
D.0.1mol·L−1HCOONa溶液和0.1mol·L−1HCOOH溶液等体积混合后混合液的pH=3.75(混合后溶液体积变化忽略不计)
难度: 困难查看答案及解析
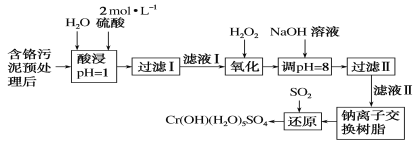
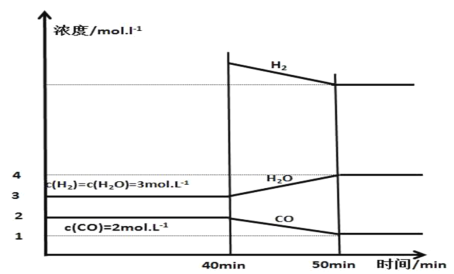
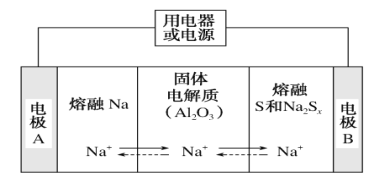
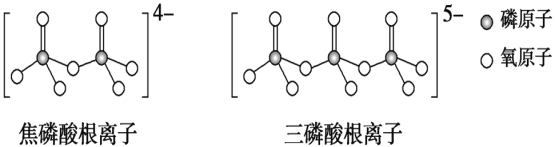

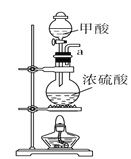 B.
B. 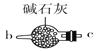 C.
C. 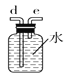 D.
D.