-
下列属于弱电解质的是
A. 氨水 B. 蔗糖 C. 干冰 D. 碳酸
难度: 中等查看答案及解析
-
[2015山东理综]进行化学实验时应强化安全意识。下列做法正确的是
A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
难度: 中等查看答案及解析
-
用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是
A.实验服 B.橡胶手套 C.护目镜 D.防毒面罩
难度: 简单查看答案及解析
-
使用玻璃、陶瓷等仪器的操作中不能承受温度急剧变化。下列操作不是基于上述原因的是( )
A.用排水法收集气体后,先移出导气管,后熄灭酒精灯
B.钠与水反应时,只取黄豆粒大小的钠投入盛水的烧杯中反应
C.在用二氧化锰和浓盐酸制氯气时,先加入二氧化锰,再加入浓盐酸,然后点燃酒精灯
D.氯化铵和氢氧化钙制氨气实验后,将大试管从铁架台上取下置于石棉网上,冷却后再洗涤
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
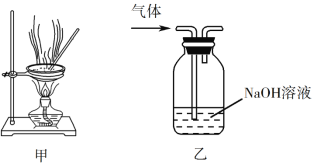
A. 用经水湿润的pH试纸测量溶液的pH
B. 将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L−1NaOH溶液
C. 用装置甲蒸干AlCl3溶液制无水AlCl3固体
D. 用装置乙除去实验室所制乙烯中的少量SO2
难度: 简单查看答案及解析
-
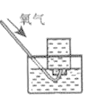
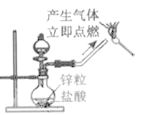
下列实验能达到实验目的且符合安全要求的是
A.制备氢氧化亚铁并观察其颜色
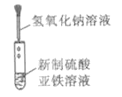
B.收集氧气
C.制备并检验氢气的可燃性
D.浓硫酸稀释
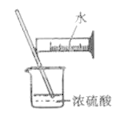
难度: 中等查看答案及解析
-
下列说法正确的是
A.用试管夹夹试管应从试管底往上套,拇指按在试管夹的短柄上
B.装碘的试剂瓶中残留的碘可以用酒精洗涤
C.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线
D.定容时,俯视刻度线,会使所配溶液的浓度偏低
难度: 中等查看答案及解析
-
下列操作或方法合理的是( )
A.用饱和碳酸钠除去 CO2中的HCl B.用澄清石灰水鉴别苏打和小苏打
C.用淀粉碘化钾鉴别碘水和溴水 D.用溴水除去乙烷中的乙烯
难度: 中等查看答案及解析
-
实验室常用如图所示的两套装置测量所制得气体的体积,下面有关这两套量气装置的使用说明有错误的是
A.使用A装置量气前,其右管中应充满相应的液体
B.量气前,B装置中广口瓶通常应盛满相应的液体
C.A装置收集完气体后,在读数前应使盛液管内液面与集气管内液面相平
D.A装置是直接测量气体体积,而B装置直接测量的是所排出液体的体积
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.苯与CCl4两种有机物可用酸性高锰酸钾溶液鉴别
B.植物油不断滴加到溴水中,溴水逐渐变浅直至褪色
C.除去固体NaCl中少量KNO3杂质,可溶于水配成溶液后蒸发浓缩、冷却结晶
D.液溴保存时液面覆盖一层水,装在带玻璃塞的棕色细口试剂瓶中
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是( )
A.
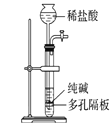 制取少量纯净的CO2气体
制取少量纯净的CO2气体B.
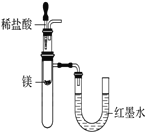 验证镁和稀盐酸反应的热效应
验证镁和稀盐酸反应的热效应C.
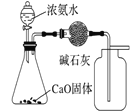 制取并收集干燥纯净的NH3
制取并收集干燥纯净的NH3D.
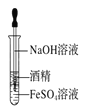 制备Fe(OH)2并能保证较长时间观察到白色
制备Fe(OH)2并能保证较长时间观察到白色难度: 中等查看答案及解析
-
下列关于纸层析的说法中正确的是
A.纸层析中在距滤纸条末端约2厘米处用钢笔画一个小圆点作为原点
B.应沿试管壁小心地将展开剂慢慢倒入试管底部
C.纸层析法适合分离结构相近、性质相似的微量物质
D.点样后的滤纸需晾干后,才能将其浸入展开剂中且浸没试样点
难度: 简单查看答案及解析
-
下列说法不正确的是
A.用量热计测定盐酸与氢氧化钠溶液的反应热时,完成一次实验共要用温度计三次
B.冬季时的乙酸常结成冰状固体,取用时可先将试剂瓶置于石棉网上用小火加热使乙酸熔化,再倾倒法或用胶头滴管吸取
C.向试管中依次加入NaOH酚酞混合溶液、乙酸乙酯,再置于水浴中加热,实验过程中不可以振荡试管以防止乙酸乙酯萃取酚酞而造成界面模糊不清
D.在实验室要得到干燥沉淀,常用方法有抽滤、用无水乙醇洗涤、用滤纸吸干以及放入干燥器中晾干
难度: 中等查看答案及解析
-
下列实验现象与实验操作不相匹配的是
实验操作
实验现象
A
向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
B
将镁条点燃后迅速伸入集满CO2的集气瓶
集气瓶中产生浓烟并有黑色颗粒产生
C
向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸
有刺激性气味气体产生,溶液变浑浊
D
向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学是认识和创造物质的科学,下列说法不正确的是( )
A.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础
B.在人类研究物质微观结构的过程中,光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了使用
C.根据酸碱质子理论,CO32-属于酸
D.燃煤烟气脱硫、汽车尾气的消除、二氧化碳的回收均体现了化学对环境保护的贡献
难度: 简单查看答案及解析
-
下列有关物质的分类正确的是
A.混合物:水玻璃、碱石灰、明矾 B.酸:稀硫酸、次氯酸、硫酸氢钠
C.酸性氧化物:
、
、
D.碱性氧化物:CaO、
、
难度: 中等查看答案及解析
-
设 NA为阿伏加德罗常数的值,下列说法正确的是( )
A.足量铜与 100mL 18mol/L 的浓硫酸在一定条件下反应转移的电子数目为1.8 NA
B.常温下,pH=13 的氢氧化钠溶液中由水电离出的H+的数目为 10-13NA
C.标准状况下,2.24 L CCl4含有的共价键数为 0.4NA
D.加热条件下,16g O2、O3的混合气体与足量镁粉充分反应转移的电子数目为 2NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.水分子间存在氢键,所以水常温下以液态存在并且化学性质非常稳定
B.常温、常压下以液态存在的物质一定都是由分子构成,因此该液体一般无法导电
C.硫酸钾在熔融状态下离子键被削弱,形成定向移动的离子,因此能导电
D.冰醋酸晶体溶于水的过程中即破坏了分子间作用力,也破坏了部分分子内作用力
难度: 中等查看答案及解析
-
下列物质的用途利用了其还原性的是( )
A.用葡萄糖制镜或保温瓶胆 B.用 Na2S除去废水中的 Hg2+
C.用 Na2SiO3溶液制备木材防火剂 D.用 K2FeO4作为高效水处理剂
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
B.C3H6与C4H8一定互为同系物
C.全降解塑料
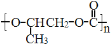 可由环氧丙烷
可由环氧丙烷和 CO2缩聚制得
D.一定条件下,完全燃烧 14 g 含氧质量分数为 a 的乙烯和乙醛的混合气体,生成水的质量为18(1-a)g
难度: 中等查看答案及解析
-
氧化性:Br2 > Fe3+> I2,向含 a mol FeI2 和 a mol BaCl2 的混合溶液中缓慢通入 b mol Br2,并不断搅拌,溶液中离子的物质的量随 Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化)。则下列说法不正确的是( )
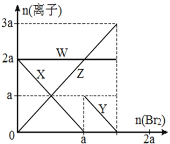
A.离子的还原性 I-> Fe2+> Br-
B.四条线与溶液中离子的对应关系是: X-Fe2+、Y-I-、Z-Br-、W-Cl-
C.当4a =3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+):c(Br-) = 1:2:8
D.当3a≤2b时,发生的离子方程式:2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br-
难度: 困难查看答案及解析
-
CO 和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g)⇌CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是( )
A.CO 全部转化为乙醇
B.断 4NA个H-H 键的同时,生成 46g 乙醇
C.若反应在恒温密闭容器中进行,容器中气体密度不再改变
D.若反应在绝热密闭容器中进行,容器中温度不再改变
难度: 简单查看答案及解析
-
科研人员设想利用如图所示的装置生产硫酸,下列有关说法正确的是( )
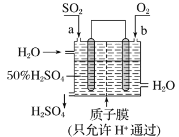
A.a 为正极,b 为负极
B.生产过程中氢离子由右移向左
C.从左下口流出的硫酸的质量分数一定大于 50%
D.负极反应式为 SO2+2H2O-2e-=SO42-+4H+
难度: 中等查看答案及解析
-
向 20mL 0.5mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的说法错误的是( )
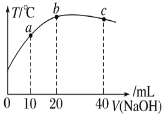
A.醋酸的电离平衡常数:b 点>a 点
B.由水电离出的 c(OH-):b 点>a 点
C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-)
D.b 点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
8.34g FeSO4•7H2O 样品在隔绝空气条件下受热脱水 过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是( )
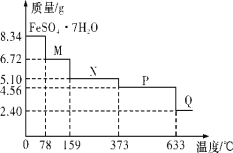
A.温度为 80℃时固体物质 M 的化学式为 FeSO4•5H2O
B.温度为 200℃时固体物质N 化学式为 FeSO4•3H2O
C.在隔绝空气条件下由N 到 P 的化学方程式为FeSO4
FeO+SO3↑
D.取 380℃ 时所得的样品 P,隔绝空气加热至 650℃, 得到的固体物质 Q 的化学式为 Fe2O3,同时有两种无色气体生成
难度: 困难查看答案及解析
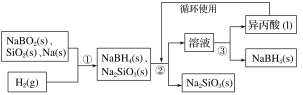
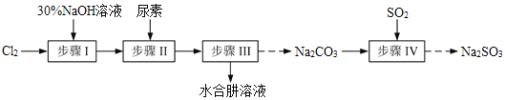
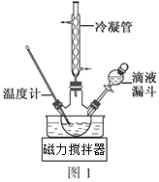
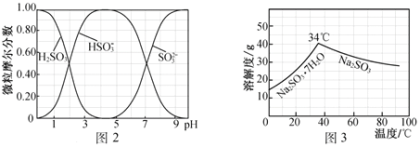
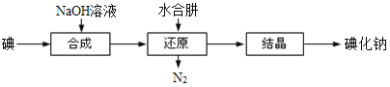
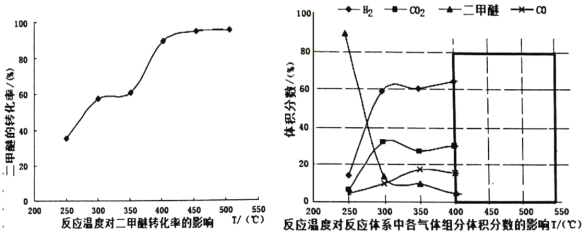
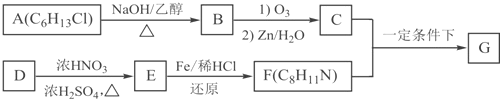
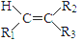

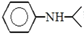 (N-异丙基苯胺)
(N-异丙基苯胺)