-
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 简单查看答案及解析
-
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1molNaAl(OH)2CO3最多可消耗3 mol H+
D. 该药剂不适合于胃溃疡患者服用
难度: 简单查看答案及解析
-
镁铝合金5.1 g溶于300mL2mol/L的HCl,在标准状况下放出气体的体积为5.6L。向反应后的溶液中加入足量氨水,产生沉淀的质量为
A.5.1g B.10.2g C.13.6g D.15.3g
难度: 困难查看答案及解析
-
下列有关物质保存的说法正确的组合是( )
①钠应该密封在煤油中保存
②过氧化钠可以露置在空气中保存
③氯水应该密封在无色试剂瓶中保存
④硫酸亚铁溶液不能露置在空气中保存
A.①③ B.①②③④
C.①③④ D.①④
难度: 简单查看答案及解析
-
下列装置或操作能达到实验目的的是( )
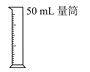
A.量取8.5mL稀硫酸
 B.制备氢氧化亚铁
B.制备氢氧化亚铁 C.防止铁钉生锈
C.防止铁钉生锈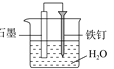 D.用酒精萃取水中的溴
D.用酒精萃取水中的溴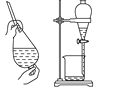
难度: 中等查看答案及解析
-
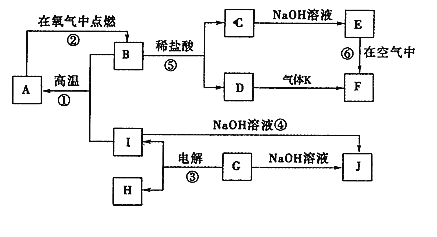
下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
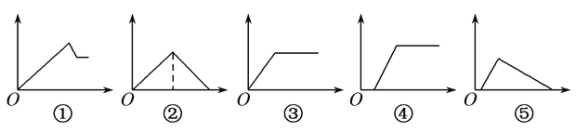
溶液
加入物质
相应序号
(1)氯化铝溶液
加入过量氨水
(2)饱和澄清石灰水
通入过量CO2气体
(3)含少量NaOH的偏铝酸钠溶液
通入过量CO2气体
(4)含少量NaOH的偏铝酸钠溶液
逐滴加入稀盐酸
(5)MgCl2、AlCl3的混合溶液
逐滴加入NaOH溶液至过量
A.①③②④⑤ B.③⑤④②①
C.①②③④⑤ D.③②④⑤①
难度: 中等查看答案及解析
-
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3④(NH4)2CO3 ⑤NaHSO4
A.①②③ B.②③⑤ C.②③ D.①②③④
难度: 中等查看答案及解析
-
下列解释相关问题或实验的离子方程式不正确的是( )
A.NaClO溶液呈碱性:ClO-+H2O
HClO+OH-
B.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O
Fe(OH)3(胶体)+3H+
C.粗盐提纯中除去Mg2+:Mg2++2OH-=Mg(OH)2↓
D.工业上精炼粗铜的阴极反应:Cu-2e-=Cu2+
难度: 简单查看答案及解析
-
下列说法不正确的是
A.铅蓄电池在放电过程中,正负极质量均增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> 0
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小
D.将浓度为0.1mol·L-1的HF溶液加水不断稀释,
的值始终保持增大
难度: 中等查看答案及解析
-
在下列各溶液中通入足量CO2气体,最终有浑浊产生的是
①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④CaCl2溶液 ⑤Na2SiO3溶液 ⑥NaAlO2溶液
A.全部 B.除①④外 C.除①②③外 D.①⑤⑥
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA
B.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.3NA
C.标准状况下,22.4 L CH4与22.4 LCl2混合光照后所得气体中分子总数为2NA
D.1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 中等查看答案及解析
-
常温下,下列各组粒子在指定溶液中能大量共存的是
A.含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HS-
B.加入Al有H2生成的溶液中Cu2+、NH4+、Cl-、NO3-
C.使酚酞变红的溶液中:K+、Na+、AlO2-、CO32-
D.小苏打溶液中:K+、Al3+、Cl-、SO42-
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.由2Cu + O2 = 2CuO可推出同族的硫也有Cu + S = CuS
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.Mg能在CO2中燃烧,所以Na也能在CO2中燃烧
D.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
难度: 简单查看答案及解析
-
对于达到平衡的可逆反应:X + Y
W + Z,其他条件不变时,增大压强,正、逆反应速率(v)的变化如图所示。下列对X、Y、W、Z四种物质状态的描述正确的是
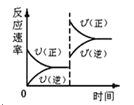
A.W、Z均为气体,X、Y中只有一种为气体
B.X、Y均为气体,W、Z中只能有一种为气体
C.X、Y或W、Z中均只有一种为气体
D.X、Y、Z、W均为气体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D.AgCl悬浊液中存在平衡: AgCl(s)
Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
难度: 中等查看答案及解析
-
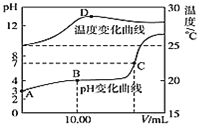
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
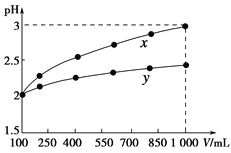
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
难度: 中等查看答案及解析
-
下列表达式正确的是
A.热化学反应方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ·mol-1
B.用碳电极电解CuSO4溶液离子反应方程式:2Cu2++2H2O
2Cu↓+O2↑+4H+
C.用电子式表示H2O中化学键形成过程:H2+O→H:O:H
D.过量的CO2通入NaAlO2溶液的化学方程式:2NaAlO2+CO2+3H2O=Al(OH)3↓+Na2CO3
难度: 简单查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是
A.在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2: Ba(OH)2、KOH、K2CO3、BaCO3
B.在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3
C.在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+
难度: 困难查看答案及解析