-
生态文明建设是中国特色社会主义事业的重要内容。下列做法不符合生态文明的是
A.研发可降解高分子材料,减少“白色污染”
B.经常使用一次性筷子、纸杯、塑料袋等
C.控制含磷洗涤剂的生产和使用,防止水体富营养化
D.分类放置生活废弃物
难度: 中等查看答案及解析
-
“乃焰硝、硫磺、杉木炭所合,以为烽燧铳机诸药者”是对我国古代四大发明之一的火药的描述。其中,“焰硝”是
A.KClO3 B.Na2SO4 C.KNO3 D.Na2O2
难度: 简单查看答案及解析
-
下列物质的工业制法错误的是
A.氨气:加热氢氧化钙和氯化铵的混合物
B.金属锰:高温下铝和二氧化锰反应
C.粗硅:高温下焦炭还原二氧化硅,副产物为CO
D.硫酸:黄铁矿煅烧生成的气体经接触氧化后用浓硫酸吸收
难度: 中等查看答案及解析
-
以淀粉为基本原料制备聚乙烯和乙酸。下列说法正确的是
A.淀粉和葡萄糖都是营养物质,均能在体内发生水解、氧化反应
B.工业上以石油为原料制取聚乙烯,需经裂解、加聚等反应
C.燃烧等物质的量的乙烯和乙醇耗氧量不同
D.乙醇和乙酸发生酯化反应制乙酸乙酯,原子利用率为100%
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,3.6g D2O2含有的共价键数为0.3NA
B.0.2mol/L K2SO3溶液中SO32—的离子总数小于0.2NA
C.实验室采用不同方法制得lmol O2,转移电子数一定是4NA
D.标准状况下将2.24LSO3溶于水,溶液中SO42—的数目为0.1NA
难度: 中等查看答案及解析
-
某混合溶液中所含离子的浓度如下表,则X离子可能为
所含离子
NO3—
SO42—
H+
X
浓度mol/L
2
1
2
1
A.Cl— B.Ba2+ C.Fe2+ D.Mg2+
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.钾和冷水反应:K+H2O=K++OH—+H2↑
B.氢氧化铁溶于氢碘酸:2Fe3++2I—=2Fe2++I2
C.碳酸氢铵稀溶液中加入足量烧碱溶液:HCO3—+ NH4++2OH—=CO32—+ NH3·H2O+H2O
D.硫代硫酸钠溶液与稀硫酸混合:3S2O32—+2H+=4S↓+2SO42—+H2O
难度: 中等查看答案及解析
-
下列实验操作能实现相应实验目的的是
实验目的
实验操作
A
比较Cl和S的非金属性
往Na2S溶液中通入氯气,观察溶液是否变浑浊
B
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
C
制取氢氧化铁胶体
将FeCl3溶液滴入NaOH溶液
D
比较HClO和H2CO3的酸性
测量并比较等浓度NaClO与Na2CO3溶液的pH
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在Na2Cr2O7酸性溶液中,存在平衡2CrO42—(黄色)+2H+⇌Cr2O72—(橙红色)+H2O,已知:25℃时,Ksp(Ag2CrO4)=1×10—12 Ksp(Ag2Cr2O7)=2×10—7。下列说法正确的是
A.当2c( Cr2O72—)=c(CrO42—)时,达到了平衡状态
B.当pH=1时,溶液呈黄色
C.若向溶液中加入AgNO3溶液,生成Ag2CrO4沉淀
D.稀释Na2Cr2O7溶液时,溶液中各离子浓度均减小
难度: 中等查看答案及解析
-
W、X、Y和Z为原子序数依次增大的四种短周期元素,最外层电子数之和为18。X、Z同一主族,Z的一种氧化物的水化物为具有还原性且不稳定的二元酸;Y的周期数是族序数的3倍。下列说法错误的是
A.简单离子半径:W>X>Y
B.X、Z的最高化合价不相同
C.简单氢化物的热稳定性:X>W
D.Y与其他三种元素分别形成的化合物中均只含离子键
难度: 中等查看答案及解析
-
废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。为研究不同pH下用NaClO氧化废水中的氨氮(用硝酸铵模拟),使其转化为无污染的气体,试剂用量如下表。已知:HClO的氧化性比ClO—的氧化性更强。下列说法错误的是
pH
0.100mol/L
NH4NO3(mL)
0.100mol/L
NaClO(mL)
0.200mol/L
H2SO4(mL)
蒸馏水
(mL)
氨氮去除
率(%)
1.0
10.00
10.00
10.00
10.00
89
2.0
10.00
10.00
V1
V2
75
6.0
……
……
……
……
85
A.V1=2.00
B.pH=1时发生反应:3ClO—+2NH4+=3Cl—+N2↑+3H2O+2H+
C.pH从1升高到2,氨氮去除率降低的原因是更多的HClO转化为ClO—
D.pH控制在6时再进行处理更容易达到排放标准
难度: 中等查看答案及解析
-
某有机物W的结构简式为
下列有关W的说法错误的是
A.是一种酯类有机物 B.含苯环和羧基的同分异构体有3种
C.所有碳原子可能在同一平面 D.能发生取代、加成和氧化反应
难度: 中等查看答案及解析
-
一定符合以下转化过程的X是( )
X
溶液W
Z
X
A.FeO B.SiO2 C.Al2O3 D.NH3
难度: 中等查看答案及解析
-
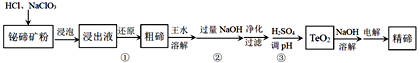
辉钼精矿主要成分是二氧化钼(MoS2),还含有石灰石、石英、黄铜矿(CuFeS2)等杂质。某学习小组设计提取MoS2的过程如下:下列说法错误的是
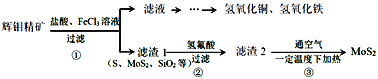
A.为加快辉钼精矿溶解,可将矿石粉粹并适当加热
B.加滤液中含Ca2+、Fe2+、Fe3+、Cu2+、H+等离子
C.以上①②③过程均涉及氧化还原反应
D.步骤③温度不宜过高,以免MoS2被氧化
难度: 中等查看答案及解析
-
铝在酸性或碱性溶液中均可与NO3—发生氧化还原反应,转化关系如下图所示:

下列说法错误的是
A.B溶液含[Al(OH)4]—
B.A溶液和B溶液混合无明显现象
C.D与F反应生成盐
D.E排入大气中会造成污染
难度: 中等查看答案及解析
-
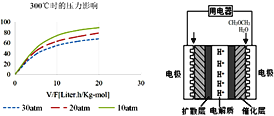
用NaOH溶液吸收烟气中的SO2,将所得的吸收液用三室膜电解技术处理,原理如图所示.下列说法错误的是
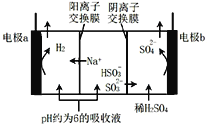
A.电极a为电解池阴极
B.阳极上有反应HSO3—-2e—+H2O=SO42—+3H+发生
C.当电路中通过1mol电子的电量时,理论上将产生0.5mol H2
D.处理后可得到较浓的H2SO4和NaHSO3产品
难度: 中等查看答案及解析
-
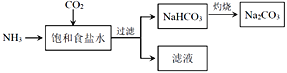
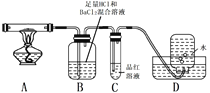
碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O下列说法正确的是
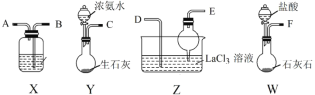
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.实验开始时应先打开W中分液漏斗的旋转活塞
D.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
难度: 中等查看答案及解析
-
常温下,将1.0L X mol/L CH3COOH溶液与0.1mol NaOH固体混合充分反应,再向该混合溶液中通人HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列说法正确的是
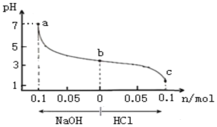
A.X<0.1
B.b→a过程中,水的电离程度逐渐增大
C.Ka (CH3COOH) =10-8/(X-0.1)
D.b→c过程中,c(CH3COOH)/c(CH3COO) 逐渐变小
难度: 中等查看答案及解析