-
下列说法中,错误的是( )
A. 人类目前所直接利用的能量大部分是由化学反应产生的
B. 煤、石油、天然气是当今世界最重要的三种化工燃料
C. 人体运动所消耗的能量与化学反应无关
D. 我国目前最主要的能源是煤炭
难度: 简单查看答案及解析
-
下列有关电池的说法不正确的是
A. 手机上用的锂离子电池属于二次电池
B. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C. 甲醇燃料电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
下列与有关非金属元素叙述以及推理结果不正确的是( )
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为F2+2Cl-=Cl2+2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>As,故前者的气态氢化物稳定性更强
④非金属性O>N,故O2与H2化合比N2更容易
A. ②③ B. ③④ C. ①④ D. ①②
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表
元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.080
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是( )
A.单质与稀硫酸反应的速率快慢:R>X>Y
B.离子半径:T2->X2+
C.元素最高价氧化物的水化物的碱性:Y>R>X
D.单质与氢气化合由易到难:Z>T
难度: 中等查看答案及解析
-
下列物质间的反应,其能量变化符合如图的是( )
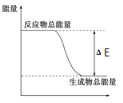
A.碳酸钙的分解
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.铝热反应
难度: 简单查看答案及解析
-
下列关于化学用语的表述正确的是( )
A.原子核内有8个中子的碳原子
C
B.HClO的结构式为H-Cl-O
C.Ca2+的结构示意图为
D.NH4Cl的电子式
难度: 中等查看答案及解析
-
恒温恒容条件下,能说明反应A(s)+2B(g)⇌C(g)+D(g)一定处于化学平衡状态的是
A.C的浓度不再改变 B.容器内的压强保持不变
C.C与D的物质的量相等 D.消耗1mol B的同时生成0.5mol D
难度: 中等查看答案及解析
-
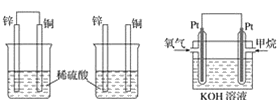
下列装置中能构成原电池的是( )
A.
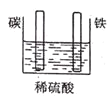 B.
B.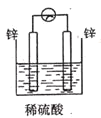 C.
C.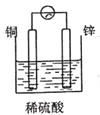 D.
D.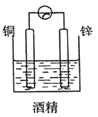
难度: 简单查看答案及解析
-
在密闭容器中进行反应X+2Y⇌2Z,已知反应中X、Y、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是
A.X为0.2mol/L B.Y为0.5mol/L
C.Z为0.35mol/L D.Y为0.10mol/L
难度: 中等查看答案及解析
-
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
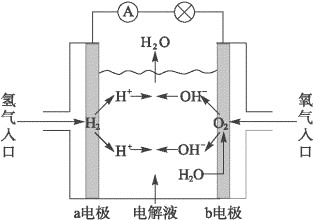
A.a电极是负极
B.b电极的电极反应为:4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③ B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲
乙
丙
装置
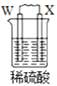
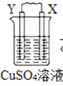
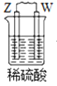
现象
金属W不断溶解
Y 的质量增加
W上有气体产生
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e−=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
难度: 中等查看答案及解析
-
对于可逆反应4NH3+5O2
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.反应达到平衡时,反应物的转化率一定小于100%
难度: 困难查看答案及解析
-
在通风橱中进行下列实验:
步骤
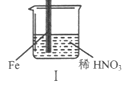
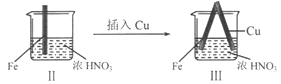
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
下列说法不正确的是
A.I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B.II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
难度: 中等查看答案及解析
-
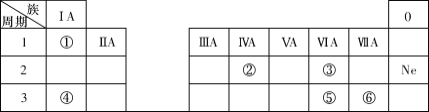
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
难度: 中等查看答案及解析
-
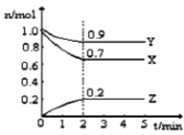
工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是
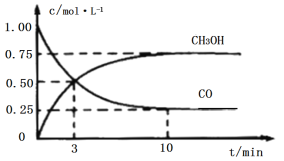
A.反应的化学方程式:CO+2H2⇌CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,ʋ(CO)=0.075mol/(L·min−1)
D.反应至3分钟,用甲醇来表示反应的平均速率为
mol/(L·min−1)
难度: 中等查看答案及解析