-
下列变化属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①②④ B.②③ C.①④⑤ D.②④
难度: 简单查看答案及解析
-
在2A+B=3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
难度: 简单查看答案及解析
-
ETH天文研究报道称组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A.20Ne和22Ne互为同位素 B.20Ne和22Ne互为同素异形体
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
难度: 简单查看答案及解析
-
锂电池是一代新型高能电池,它以质量轻、能量高而重视,目前已研制成功多种锂电池。某种锂电池的总反应方程式为Li+MnO2===LiMnO2,下列说法正确的是( )
A. Li是正极,电极反应式为Li-e-=Li+
B. Li是负极,电极反应式为Li-e-=Li+
C. MnO2是负极,电极反应式为MnO2+e-=MnO2-
D. Li是负极,电极反应式为Li-2e-=Li2+
难度: 中等查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt不溶于水也不溶于稀硝酸
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.②④ B.①②③④
C.①③⑤ D.②④⑤
难度: 简单查看答案及解析
-
下列关于化学反应中能量变化的说法正确的是
A.断开化学键会释放能量 B.氧化还原反应均为放热反应
C.化学反应过程中一定伴有能量变化 D.需要加热才能发生的反应一定是吸热反应
难度: 中等查看答案及解析
-
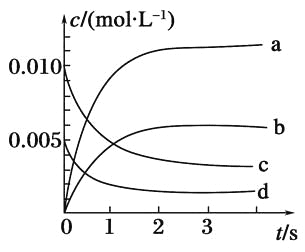
在密闭容器中进行反应X+2Y⇌2Z,已知反应中X、Y、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是
A.X为0.2mol/L B.Y为0.5mol/L
C.Z为0.35mol/L D.Y为0.10mol/L
难度: 中等查看答案及解析
-
在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2mol•L-1 降到 0.8mol•L-1 需要 20s,那么反应物浓度再由 0.8mol•L-1 降到 0.2mol•L-1 所需要的时间为
A.10s B.大于 10s C.小于 10s D.无法判断
难度: 中等查看答案及解析
-
下列说法正确的是
A.人体运动所消耗的能量与化学反应无关
B.在反应C+CO2⇌2CO中,若v(CO)为1mol·(L·min)−1,则v(C)为0.5mol·(L·min)−1
C.决定化学反应速率的主要因素为反应温度
D.锌锰干电池中,锌电极是负极
难度: 简单查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子 B.H2O与D2O互称同素异形体
C.1H与D互称同位素 D.1H218O与D216O的相对分子质量相同
难度: 简单查看答案及解析
-
可逆反应:
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成
的同时生成
②单位时间内生成
的同时生成
③用
、
、
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
氢化钠
化合物中钠元素是
价,NaH跟水反应放出
,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与
不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气
难度: 中等查看答案及解析
-
如图所示,将锌片和铜片按不同方式插入稀硫酸中,下列说法正确的是( )
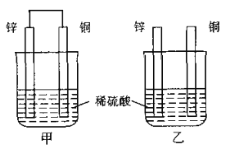
A. 甲中电子经导线从铜片流向锌片
B. 两烧杯中锌片上均发生还原反应
C. 两烧杯中铜片表面均无气泡产生
D. 一段时间后,两烧杯中溶液的c(H+)均减小
难度: 简单查看答案及解析
-
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是
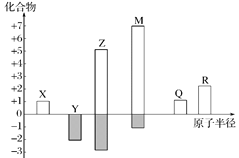
A.Q位于第三周期ⅠA族
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.简单离子半径:M->Q+>R2+
D.Z与M的最高价氧化物对应水化物均为强酸
难度: 困难查看答案及解析
-
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置
部分实验现象
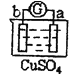
a极质量减小,b极质量增加
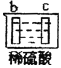
b极有气体产生,c极无变化
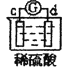
d极溶解,c极有气体产生
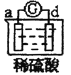
电流计指示在导线中电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
难度: 中等查看答案及解析