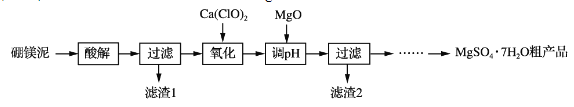
-
习总书记在十九大报告中提出“我们要建设的现代化是人与自然和谐共生的现代化”,下列说法正确的是
A.在田间焚烧秸秆,以增加草木灰肥料从而减少化肥的使用
B.推广使用可降解塑料及布袋购物,以减少“白色污染”
C.用氯气处理水中的Cu2+、Hg2+等重金属离子
D.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
难度: 中等查看答案及解析
-
反应2HClO+Mg=Mg(ClO)2++H2↑。下列表示反应中相关微粒的化学用语正确的是
A.中子数为20的氯原子:
Cl B.次氯酸的电离方程式:HClO=H++ClO-
C.次氯酸的电子式:
D.镁离子的结构示意图:
难度: 中等查看答案及解析
-
下列物质性质与应用对应关系正确的是
A.氨气具有还原性,可用作制冷剂
B.Na2O2呈浅黄色,可用作潜水艇中的供氧剂
C.二氧化硅能与氢氟酸反应,可用于制光导纤维
D.明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色透明的溶液中:Na+、MnO4-、SO32-、Br-
B.
=1×10-12的溶液中:Na+、K+、CO32-、NO3-
C.能使甲基橙变红的溶液:Mg2+、Na+、HCO3-、Cl-
D.0.1 mol·L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I-
难度: 中等查看答案及解析
-
NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是
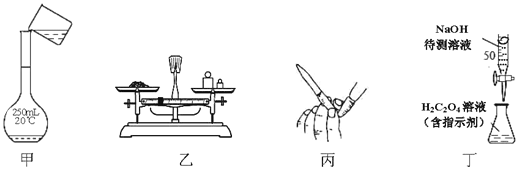
A.用图甲所示操作转移NaOH溶液到容量瓶中
B.用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体
C.用图丙所示操作排除碱式滴定管中的气泡
D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液
难度: 中等查看答案及解析
-
下列有关化学反应的叙述正确的是
A.Fe在稀硝酸中发生钝化
B.向苯酚钠溶液中通少量的二氧化碳生成NaHCO3
C.AlCl3与过量氨水反应生成NaAlO2
D.Fe少量的Cl2在高温下反应生成FeCl2
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.醋酸溶解水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氨水中通入过量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.用石墨作电极电解MgCl2溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z主族序数是周期序数的3倍,W是短周期中金属性最强的元素。下列说法正确的是
A.原子半径:r(X) < r(Y) < r(Z) < r(W)
B.W的最高价氧化物的水化物是一种弱碱
C.Y氢化物的稳定性比Z的氢化物的稳定性强
D.X、Y、Z 三种元素可以组成共价化合物或离子化合物
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①FeS2
SO2
H2SO4
②SiO2
SiCl4
Si
③饱和NaCl溶液
NaHCO3
Na2CO3
④0.1 mol·L-1HCl(aq)
Cl2
Ca(ClO)2
⑤CuSO4(aq)
Cu(OH)2
Cu2O
A.①③⑤ B.①③④ C.②④⑤ D.①④⑤
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
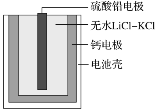
A.放电过程中,Cl-向正极移动
B.正极反应式:PbSO4+2e-=Pb+SO42-
C.反应每转移0.1mol电子,负极理论上消耗4g Ca
D.常温时,在正负极间接上电流表,指针发生偏转
难度: 中等查看答案及解析
-
合成药物异搏定路线中某一步骤如下:
+
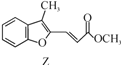
下列说法正确的是
A.物质X在空气中易被氧化
B.物质Z与氢气完全加成后的物质中含有3个手性碳原子
C.物质Y能发生取代、消去、加成反应
D.等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶1
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向K2MnO4溶液(墨绿色)中加入醋酸,溶液逐渐变为紫色且有黑色沉淀
醋酸具有氧化性
B
向Fe(NO3)2溶液中滴入HI和淀粉混合溶液,溶液变蓝
氧化性:Fe2+>I2
C
向苯酚钠溶液中通入CO2,溶液变浑浊
结合H+能力:C6H5O->CO32->HCO3-
D
将K2CrO4滴入AgNO3溶液至不再产生沉淀,再滴加相同浓度的Na2S溶液,沉淀由红棕色转化为黑色
Ksp(Ag2CrO4)>Ksp(Ag2S)
A.A B.B C.C D.D
难度: 中等查看答案及解析
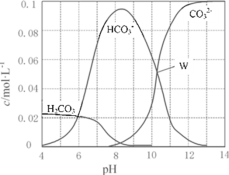
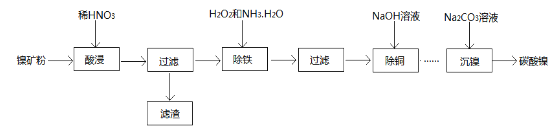
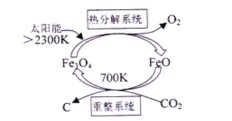
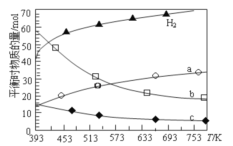
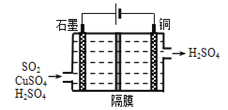
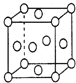
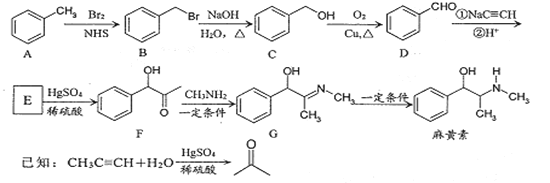
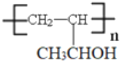 的合成路线流程图________(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图________(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)。