-
文房四宝即笔、墨、纸、砚,其中以湖笔、徽墨、宣纸和端砚最为称著。下列说法正确的是
A.徽墨中墨的主要成分是黑色的油脂 B.湖笔中笔头的羊毫的主要成分是蛋白质
C.宣纸的主要成分是无机碳和少量的纤维素 D.含较多氧化铁的端砚呈黑色
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.将11.2LCl2通入足量的NaOH溶液中充分反应,转移的电子数为0.5NA
B.常温下,1.0LpH=1的H2SO4溶液中含有H+的数目为0. 2NA
C.4.4 g由CO2和N2O组成的混合气体中含有的电子总数为2.2NA
D.11.5 g乙醇分子中含有C-H键的数目为1.5NA
难度: 简单查看答案及解析
-
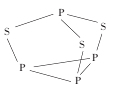
化合物(a)在乙酸汞催化下与乙酸反应生成化合物(b):
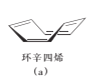
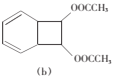
下列说法错误的是
A.(a)具有含苯环的同分异构体 B.(a)能使酸性KMnO4溶液褪色
C.(b)能发生加成聚合反应 D.(b)的一氯代物有7种
难度: 简单查看答案及解析
-
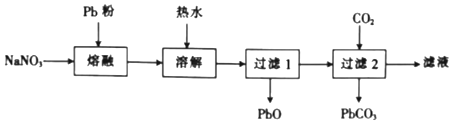
海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是
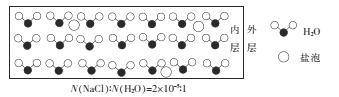
A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.每含1mol H2O的海冰内就有2×l0-5 NA个NaCl分子(NA为阿伏加德罗常数)
D.海冰内层NaCl的浓度约为l0-3 mol/L(设冰的密度为0.9 g.cm-3)
难度: 中等查看答案及解析
-
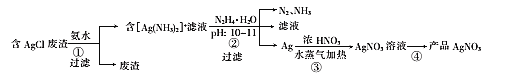
磷酸铁锂电池放电时正极的反应式为
。该电池放电时的工作原理如图所示。下列叙述正确的是
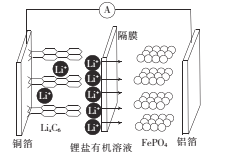
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铜箔经溶液流向铝箔
C.放电时,负极发生的电极反应:Cu-2e-=Cu2+
D.该电池放电过程中C、Fe、P元素化合价均发生变化
难度: 中等查看答案及解析
-
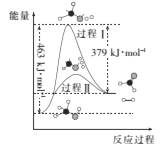
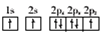
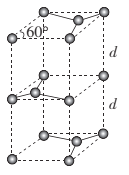
短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子序数是Z的原子序数的一半,W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是
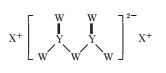
A.原子半径:Z>Y>W
B.化合物M中W的原子满足8电子稳定结构
C.对应单质的熔点:X>Z>Y
D.Z的氧化物对应的水化物为强酸
难度: 中等查看答案及解析
-
次磷酸(H3PO2一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1mol∙L-1的H3PO2溶液和1mol∙L-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示。下列说法错误的是
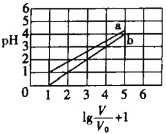
A.常温下,NaBF4溶液的pH=7
B.常温下,H3PO2的电离平衡常数约为1.1
10-2
C.NaH2PO2 溶液中:c(Na+) =c( H2PO2- ) +c( HPO22-) +c(PO23-) +c( H3PO2)
D.常温下,在0≤pH≤4时,HBF4溶液满足
难度: 困难查看答案及解析
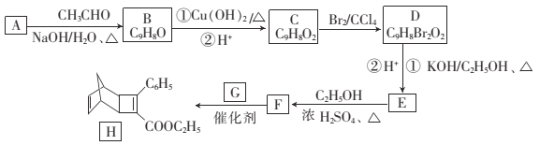
 B
B C
C E
E