-
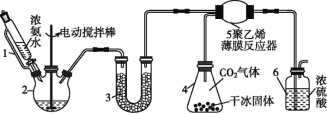
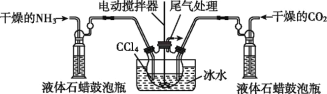
《本草纲目》中收载“烧酒”篇:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”《本草经集注》中记载有关于鉴别消石(KNO3)和朴消(Na2SO4)之法:以火烧之,紫青烟起,云是真消石也”。文字中两处渉及到“法”。分别是
A.蒸馏 焰色反应 B.萃取 升华
C.蒸馏 丁达尔效应 D.升华 焰色反应
难度: 简单查看答案及解析
-
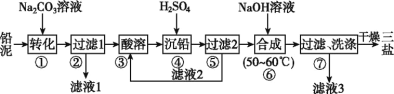
普通锌锰电池筒内无机物主要成分是MnO2、NH4Cl、ZnCl2等。某研究小组探究废旧电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是( )
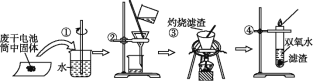
A.操作①中玻璃棒的作用是转移固体
B.操作②为过滤,得到的滤液显碱性
C.操作③中盛放药品的仪器是坩埚
D.操作④的目的是除去滤渣中的杂质
难度: 中等查看答案及解析
-
甲、乙两组有机反应类型相同的是( )
选项
甲组
乙组
A
苯与氢气在催化剂、加热条件下反应
苯与液溴在FeBr3作用下反应
B
淀粉在稀硫酸中反应生成葡萄糖
丙烯酸(CH2=CHCOOH)与乙醇在浓硫酸、加热条件下反应
C
乙醇与氧气在铜和加热条件下反应
丙烯(CH3CH=CH2)与溴的四氯化碳溶液反应
D
在酸性KMnO4溶液中滴加乙醇
在光照条件下甲烷与氯气发生反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
传感器可以检测空气中SO2的含量,传感器的工作原理如图所示。下列叙述中正确的是( )

A.b为电源的正极
B.阳极的电极反应式为Ag++Cl-=AgCl
C.当电路中电子转移5×10-5 mol时,进入传感器的SO2为1.12 mL
D.阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O
难度: 中等查看答案及解析
-
某有机物的分子式为C4H9ClO,分子中含有羟基和一个氯原子,且两者不能连到同一个碳原子上的同分异构体共有( )
A.8种 B.9种 C.10种 D.12种
难度: 中等查看答案及解析
-
V、W、X、Y、Z五种短周期主族元素,原子序数依次增大,X原子的最外层电子数是内层电子数的3倍,W的气态氢化物和最高价氧化物对应的水化物反应生成一种盐,Y是同周期中原子半径最大的元素,Z的原子序数等于V、W、X的原子序数之和。下列说法错误的是( )
A.X、Z同主族,Y、Z同周期 B.简单离子的半径:W>Y
C.V、X可形成原子个数比为1∶1、2∶1的化合物 D.气态氢化物的热稳定性:X<W
难度: 中等查看答案及解析
-
常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
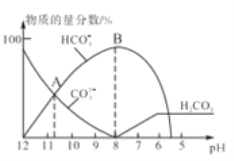
A.常温下,水解常数Kh(CO32-)的数量级为10-4
B.当溶液是中性时,溶液的总体积大于20mL
C.在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D.在B点所示的溶液中,离子浓度最大的是HCO3-
难度: 困难查看答案及解析