-
2020年4月20日,习近平总书记来到秦岭,关注山清水秀。下列做法正确的是( )
A.集中深埋废旧电池 B.远海排放工业污水
C.减少冶炼含硫矿物 D.推广使用一次性木筷
难度: 简单查看答案及解析
-
“新冠病毒”疫情让人们再次认识到化学的重要性。下列有关抗疫物资的化学用语表示正确的是( )
A.碘酊中质量数为127的碘原子:
B.供氧剂中过氧化钙(CaO2)的电子式:
C.84消毒液中次氯酸钠的电离方程式:NaClO
Na++ClO-
D.口罩“熔喷层”原料中聚丙烯的结构简式:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是 ( )
A.Al2O3难溶于水,可用作耐高温材料
B.晶体Si具有半导体性能,可用作光导纤维
C.SO2具有漂白性,可用于漂白纸张
D.ClO2具有还原性,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH
、H+、NO
、SO
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO
、Cl-
C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN-
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO
难度: 简单查看答案及解析
-
高温下,Fe2O3和H2反应可转化为Fe3O4,方程式为3Fe2O3+H2
2Fe3O4+H2O。下列说法正确的是( )
A.Fe2O3俗名磁性氧化铁
B.该反应条件下H2的还原性强于Fe3O4的还原性
C.每消耗160 g Fe2O3,反应中转移2×6.02×1023个电子
D.Fe3O4可由Fe与H2O在常温下反应制得
难度: 简单查看答案及解析
-
下列有关实验室氯气的制备、收集、性质检验及尾气处理的装置中,错误的是( )
A.
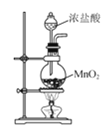 制备Cl2
制备Cl2B.
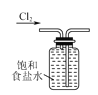 收集Cl2
收集Cl2C.
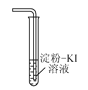 验证Cl2具有氧化性
验证Cl2具有氧化性D.
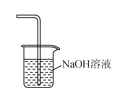 吸收Cl2尾气
吸收Cl2尾气难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.Na2O2与H2O反应:2O
+2H2O===O2↑+4OH-
B.向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO
+Ba2++2OH-===BaSO4↓+2H2O
D.向银氨溶液中加入足量盐酸:[Ag(NH3)2]++2H+===Ag++2NH
难度: 中等查看答案及解析
-
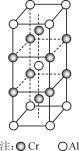
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其电子层数的2倍,Y是地壳中含量最多的金属元素,Z与X属于同一主族,W原子的最外层电子数与Y原子的最外层电子数相差3。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.X和W组成的化合物中只含共价键
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.Y的简单阳离子和W的简单阴离子具有相同的电子层结构
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
A.MgCO3
MgCl2(aq)
Mg
B.Cu2(OH)2CO3
CuO
Cu(OH)2
C.BrCH2COOH
HOCH2COOH
D.NH3
NO
HNO3
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.铜丝缠在石墨棒上插入稀硝酸,可加快NO生成速率
B.双液电池中,可用浸有CCl4的滤纸作盐桥
C.K2FeO4可用作碱性Zn-K2FeO4电池的正极材料
D.生铁发生吸氧腐蚀时的腐蚀速率与O2的浓度有关
难度: 简单查看答案及解析
-
化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
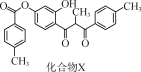
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
难度: 中等查看答案及解析
-
室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀
蛋白质发生了盐析
B
SO2通入Ba(NO3)2溶液中,产生白色沉淀
沉淀为BaSO3
C
向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体
浓硫酸具有脱水性和强氧化性
D
分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深
碳酸酸性强于苯酚
A.A B.B C.C D.D
难度: 中等查看答案及解析
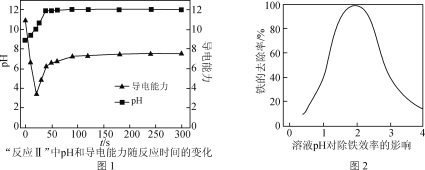
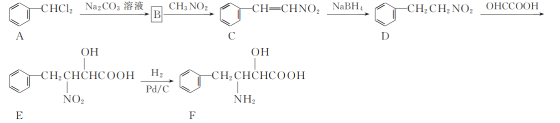
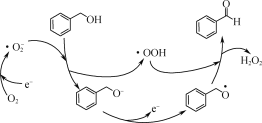
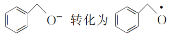 是________(填“氧化”或“还原”)反应。
是________(填“氧化”或“还原”)反应。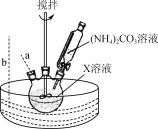
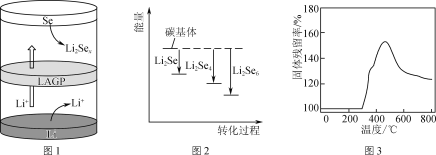
 ×100%)分析300 ℃后,固体残留率变化的原因是________。
×100%)分析300 ℃后,固体残留率变化的原因是________。