-
2019年9月25日,全世界几大空之一―—北京大兴国际机场,正式投运。下列相关说法不正确的是( )
A.机杨航站楼所用钢铁属于合金材料
B.航站楼使用的玻璃是无机非金属材料
C.航站楼采用的隔震支座由橡胶和钢板相互叠加粘结而成,属于新型无机材料
D.机场高速应用自融冰雪路面技术,减少了常规融雪剂使用对环境和桥梁结构造成的破坏
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.金属汞一旦活落在实验室地面或桌面时,必须尽可能收集,并深理处理
B.氨氮废水(含NH4+及NH3 ) 可用化学氧化法或电化学氧化法处理
C.做蒸馏实验时,在蒸馏烧瓶中应加人沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
D.用pH计、电导率仅(一种测量溶渡导电能力的仪器)均可检测乙酸乙酯的水解程度
难度: 中等查看答案及解析
-
下列说法中正确的有几项
①钠在空气中燃烧生成淡黄色的Na2O2
②配制480mL0.5mol/L的NaOH溶液,需要用托盘天平称量氢氧化钠固体9.6g
③盐酸既有氧化性又有还原性
④Fe(OH)3、FeCl2、H2SiO3都不直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
⑥将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15%
⑦干燥的Cl2和氯水均能使鲜花褪色
⑧中和热测定实验中需要用到的玻璃仪器只有烧杯、温度计和环形玻璃搅拌棒三种
⑨纯银器在空气中久置变黑是因为发生了化学腐蚀
A.3项 B.4项 C.5项 D.6项
难度: 中等查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法正确的是( )
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
B.X、Z两元素能形成原子个数比(X:Z)为3:1和4:2的化合物
C.化合物YW2、ZW2都是酸性氧化物
D.用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀
难度: 简单查看答案及解析
-
下列关于自然界中氮循环的说法错误的是
A.氮肥均含有NH4+
B.雷电作用固氮中氮元素被氧化
C.碳、氢、氧三种元素参与了自然界中氮循环
D.合成氨工业的产品可用于侯氏制碱法制备纯碱
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法中正确的是
A.4g甲烷完全燃烧转移的电子数为2NA
B.11.2L(标准状况)CCl4中含有的共价键数为2NA
C.3 mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D.1L 0.1mol·L-1的Na2S溶液中HS-和S2-离子数之和为0.1 NA
难度: 中等查看答案及解析
-
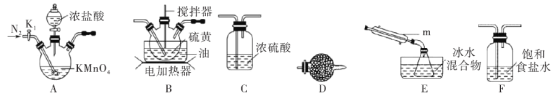
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A
分离氢氧化铁胶体与FeCl3溶液
过滤
胶体粒子不能通过滤纸
B
用乙醇提取碘水中的碘
萃取
碘在乙醇中的溶解度较大
C
用MgCl2溶液制备无水MgCl2固体
蒸发
MgCl2受热不分解
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列方程式不能正确表示某沉淀溶解过程的是
A.热的浓盐酸洗涤试管内壁的MnO2:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
B.热的NaOH溶液洗涤试管内壁的S:3S+6NaOH
2Na2S+Na2SO3+3H2O
C.向石灰石粉的悬浊液中持续通CO2:Ca(OH)2+2CO2=Ca(HCO3)2
D.稀硫酸可除去铁锈:Fe2O3+6H+=2Fe3++3H2O
难度: 中等查看答案及解析
-
R是合成某高分子材料的单体,其结构简式如图所示。下列说法错误的是( )
A.R能发生加成反应和取代反应
B.用NaHCO3溶液可检验R中是否含有羧基
C.R与HOCH2COOH分子中所含官能团完全相同
D.R苯环上的一溴代物有4种
难度: 中等查看答案及解析
-
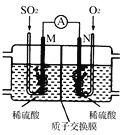
一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。
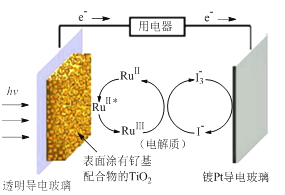
电池工作时发生的反应为:
RuII
RuII *(激发态)
RuII *→ RuIII+e-
I3-+ 2e-→3I-
RuIII+3I-→RuII++ I3-
下列关于该电池叙述错误的是 ( )
A. 电池中镀Pt导电玻璃为正极
B. 电池工作时,I-离子在镀Pt导电玻璃电极上放电
C. 电池工作时,电解质中I-和I3-浓度不会减少
D. 电池工作时,是将太阳能转化为电能
难度: 中等查看答案及解析
-
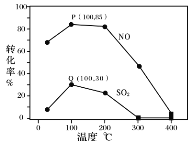
25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是

A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
难度: 困难查看答案及解析

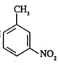 和乙醇制备
和乙醇制备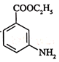 的合成路线(无机试剂任选)。________
的合成路线(无机试剂任选)。________