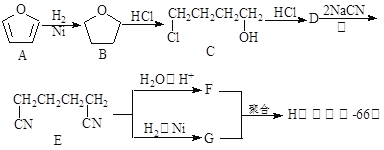-
下列各组元素的性质正确的是( )
A. 第一电离能:B>Al>Ga B. 电负性:F>N>O
C. 最高正价:F>S>Si D. 原子半径:P>N>C
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物
B.氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用
C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
难度: 中等查看答案及解析
-
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A. 蚕丝的主要成分是蛋白质
B. 蚕丝属于天然高分子材料
C. “蜡炬成灰”过程中发生了氧化反应
D. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
难度: 简单查看答案及解析
-
已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2—的空间构型为
A.直线形 B.平面正方形 C.正四面体形 D.正八面体形
难度: 简单查看答案及解析
-
13 CNMR(核磁共振)、15 NNMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wuithrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N的叙述正确的是
A.13C与15N有相同的中子数
B.13C电子排布式为1s22s22p3
C.15N与14N互为同位素
D.15N的电子排布式为1s22s22p4
难度: 中等查看答案及解析
-
甘氨酸(
)和丙氨酸(
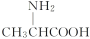 )的混合物缩合最多可形成二肽的种类( )
)的混合物缩合最多可形成二肽的种类( )A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
下列高分子材料不宜直接接触食品的是( )
A.聚丙烯 B.聚乙烯 C.聚氯乙烯 D.聚对苯二甲酸乙二醇酯
难度: 简单查看答案及解析
-
下列关于合成材料的说法中,不正确的是( )
A.塑料、合成纤维和合成橡胶都属于合成材料
B.聚氯乙烯可制成薄膜、软管等,其单体是CH2=CHCl
C.合成酚醛树脂的单体是苯酚和甲醇
D.合成顺丁橡胶(
)的单体是CH2=CH—CH=CH2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应
B.蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出,蛋白质均发生变性
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.任何一个电子层最多只有s、p、d、f四个能级
B.用n表示电子层数,则每一电子层最多可容纳的电子数为2n2
C.核外电子运动的概率密度分布图就是原子轨道
D.同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 简单查看答案及解析
-
铋的相关信息如图所示,下列说法正确的是( )

A.Bi元素的质量数是209
B.Bi元素位于第六周期第ⅤA族
C.Bi原子的6p能级上有1个未成对电子
D.Bi原子最外层有5个能量相同的电子
难度: 简单查看答案及解析
-
下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为
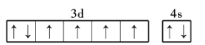
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高正化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.S、Cl的电负性和单质的氧化性均依次增强
D.元素周期表中位于金属元素和非金属元素分界线附近的元素属于过渡元素
难度: 简单查看答案及解析
-
某元素M的逐级电离能(kJ•mol﹣1)分别为580,1820,2750,11600。该元素氧化物的化学式最可能是( )
A.MO B.MO2 C.MO3 D.M2O3
难度: 中等查看答案及解析
-
下图表示蛋白质分子结构的一部分,图中A,B,C,D标出了分子中不同的键,当蛋白质发生水解反应时,断裂的键是 ( )
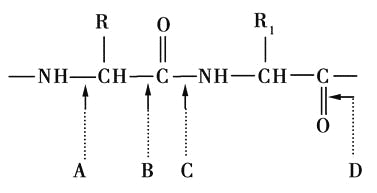
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是( )
A.H2 B.HCl C.Cl2 D.F2
难度: 简单查看答案及解析
-
下列关于三氯化磷分子的叙述不正确的是( )
A.PCl3分子中三个共价键的键长和键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能相等
D.PCl3分子中磷原子是sp2杂化
难度: 简单查看答案及解析
-
下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
难度: 中等查看答案及解析
-
某高聚物的结构式为
 ,下列分析正确的是
,下列分析正确的是A.它是缩聚反应的产物
B.其单体是CH2CH2和HCOOCH3
C.其单体为CH2CHCOOCH3
D.它燃烧后产生CO2和H2O的物质的量之比为1∶1
难度: 中等查看答案及解析
-
对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M
,N
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
难度: 简单查看答案及解析
-
下列元素的最高价氧化物对应的水化物酸性最强的是
A.原子的L电子层p轨道只填了两个电子的元素
B.外围电子排布式为3s23p2的元素
C.第三周期有7个价电子的元素
D.3p轨道电子半充满的元素
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.电负性的大小可以作为判断元素金属性和非金属性强弱的尺度
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子的核外电子排布由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.基态原子价层电子排布是5s1的元素,其氢氧化物的溶液一定不能溶解氢氧化铝
难度: 简单查看答案及解析
-
某有机物M的结构简式如下:
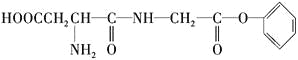
下列有关M的叙述中正确的是( )
A.M的分子式为C12H15O5N2
B.M可以发生水解反应、中和反应、加成反应、消去反应
C.M的水解产物中一定含有醇类
D.1molM最多可以与1L4mol/L的NaOH溶液完全反应
难度: 中等查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.CH4和NH4+是等电子体,键角均为60°
B.B3N3H6(B和N交替排列)和苯是等电子体,均有6mol非极性键
C.NH3和PCl3是等电子体,均为三角锥形结构
D.BF3和CO32-是等电子体,均为平面三角形结构
难度: 简单查看答案及解析