-
下列离子方程式正确的是( )
A.石灰乳与碳酸钠溶液混合:Ca2++CO32-=CaCO3↓
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液,刚好沉淀完全:Ba2+ +2OH-+2H++SO42-=BaSO4↓+2H2O
C.向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O
D.碳酸氢钠溶液中加入过量的氢氧化钙溶液:2HCO3- + Ca2+ + 2OH-=CaCO3↓+ 2H2O + CO32-
难度: 中等查看答案及解析
-
今年诺贝尔化学奖的获得者由于“设计和合成分子机器”而获奖,下列有关分子的描述正确的是( )
A.白磷分子呈正四面体,键角60° ,1mol白磷含共价键6mol
B.臭氧分子呈直线型,等质量的臭氧和氧气所含的氧原子数相同
C.S8是分子晶体,8个硫原子在同一个平面上,摩尔质量为256g
D.冰熔化时水分子中共价键发生断裂
难度: 简单查看答案及解析
-
下列表示氮原子或氮分子的化学用语中正确的是( )
A.氮分子的电子式:
B.氮原子电子排布式:1s22s22p5
C.氮分子的结构式:
D.氮原子最外层电子轨道表示式:
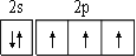
难度: 简单查看答案及解析
-
下列关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是( )
A.物质的摩尔质量等于其相对分子(原子)质量
B.物质的量是一个基本的物理量,单位是摩尔
C.0.12kg12C中所含的碳原子数为阿佛加德常数
D.1mol任何物质中都含有阿佛加德常数个原子
难度: 简单查看答案及解析
-
下列判断正确的是
A.氧化物中的氧元素一定呈 - 2价 B.酸性氧化物可能是金属氧化物
C.化学键只存在于晶体中 D.正四面体分子中键角不可能是600
难度: 简单查看答案及解析
-
以下物质的实验室制备不合理的是( )
A.用铅皿制备HF
B.用浓硫酸制备HI
C.用磨砂接口的装置制备HNO3
D.用浓硫酸制HCl
难度: 简单查看答案及解析
-
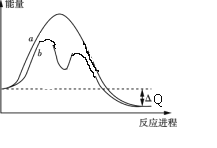
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是( )
A.AlCl3
B.Na2O
C.FeCl2
D.SiO2
难度: 简单查看答案及解析
-
能够说明硫的非金属性比氯弱的事实有
①
与铁反应生成
,S与铁反应生成FeS
②
和
的混合气,经强光照射可剧烈反应,而S与
反应需较高温度
③将
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③ B.①②③ C.②④ D.①②③④
难度: 简单查看答案及解析
-
在四个等体积的密闭容器中,分别通入等体积的下列各组气体相混合,在20℃时经过足够时间后,则容器中压强最低的是( )
A.NO和O2
B.NH3和HCl
C.CO和N2
D.H2S和SO2
难度: 中等查看答案及解析
-
下列各组离子,在溶液中因发生氧化还原反应而不能大量共存的是( )
A.K+、NH4+、NO3-、OH-
B.Na+、Ca2+、H+、HCO3-
C.K+、H +、NO3-、I-
D.K+、NO3-、Cl-、Mg2+
难度: 简单查看答案及解析
-
实验室里运用下列实验装置进行实验,能达到相应实验目的并符合环保的是( )
A
B
C
D



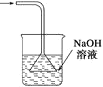
除去氯气中的杂质
制取84消毒液(NaClO)
检验二氧化硫中是否混有二氧化碳
吸收氯化氢尾气
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在硫酸酸化的碘化钾溶液里加入过量的过氧化氢溶液,不久就有无色小气泡从溶液中逸出,且溶液呈棕色,下列叙述中错误的是( )
A.溶液里滴入淀粉溶液后显蓝色
B.反应时还有H2O2分解为H2O和O2
C.离子方程式为:H2O2 +2I- +2H+=I2 +2H2O
D.离子方程式为:H2O2 +2I-=I2 +O2↑+2H+
难度: 简单查看答案及解析
-
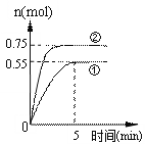
氯酸钾和亚硫酸氢钠起氧化还原反应生成Cl-和SO42-的速率如图所示。关于该反应的叙述错误的( )

A.氯酸根的氧化性强于硫酸根
B.该反应的速率可能与氢离子浓度有关
C.反应后阶段速率变慢是因为氯酸钾和亚硫酸氢钠浓度越来越小
D.该反应的离子方程式为:ClO3- +3HSO3- +3OH-=3SO42- +Cl-+3H2O
难度: 简单查看答案及解析
-
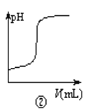
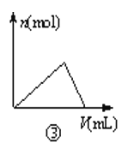
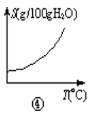
化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:有关下列曲线图的说法正确的是( )
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化

B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的硫酸溶液时pH变化
C.曲线图③可以表示向一定量的氯化铝溶液中滴加一定浓度的氢氧化钠溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
难度: 中等查看答案及解析
-
向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入不同的气体,一段时间后,下图表示通入的气体的量与溶液pH关系的曲线图,下列说法正确的是( )

A.曲线 a表示向H2S水溶液中通入O2
B.曲线 b表示向SO2水溶液中通入O2
C.曲线 c表示向H2S水溶液中通入Cl2
D.曲线 d表示向SO2水溶液中通入H2S
难度: 中等查看答案及解析
-
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O + Cu2S = 6Cu + SO2; 对于该反应,下列说法中正确的是( )
A.反应中铜元素既被氧化又被还原;
B.还原产物与氧化产物的物质的量之比为1:6;
C.Cu2S在反应中只作氧化剂;
D.反应中被氧化的元素是S
难度: 简单查看答案及解析
-
图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是

A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 中等查看答案及解析
-
某稀溶液中含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉。下列各图表示溶液中Fe2+的物质的量和加入铁粉的物质的量之间的关系,其中可能正确的是( )
A.
 B.
B.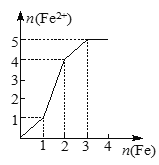
C.
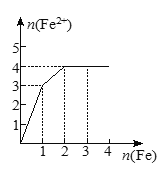 D.
D.
难度: 中等查看答案及解析
-
某无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将l00 mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为 ( )

A.NH3、NO、N2
B.NH3、NO、CO2
C.NH3、NO2、CO2
D.NO、CO2、N2
难度: 中等查看答案及解析
-
使a g Fe粉与一定量的硝酸溶液充分反应(Fe粉完全溶解),生成的气体与标准状况下b L O2混合后,恰好能被水完全吸收,a和b的关系可能是
A.b >0.3a B.b <0.2a C.0.2a<b <0.3a D.无法确定
难度: 困难查看答案及解析
-
盐田法是把海水引入盐田,利用日光、风力蒸发浓缩海水,使其达到饱和,进一步将食盐结晶出来,这种方法在化学上称为
A.蒸发结晶 B.冷却结晶 C.重结晶 D.蒸馏
难度: 简单查看答案及解析