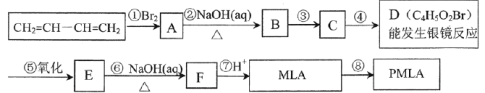
-
一些烷烃的燃烧热(kJ/mol)如下:
化合物
燃烧热
化合物
燃烧热
甲烷
891.0
正丁烷
2878.0
乙烷
1560.8
异丁烷
2869.6
丙烷
2221.5
2-甲基丁烷
3531.3
下列推断正确的是
A.热稳定性:正丁烷>异丁烷
B.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)+1560.8kJ
C.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量就越多
D.正戊烷的燃烧热大约在3540 kJ/mol左右
难度: 中等查看答案及解析
-
以下物理量只与温度有关的是
A.醋酸的电离度 B.醋酸钠的水解程度
C.水的离子积 D.氨气的溶解度
难度: 简单查看答案及解析
-
下列变化需克服共价键的是
A.金刚石熔化 B.汞受热变成汞蒸气 C.蔗糖溶于水 D.食盐溶于水
难度: 简单查看答案及解析
-
下列做法值得提倡的是( )
A.Cl2作为食品漂白剂 B.氟利昂作为制冷剂
C.Na2CO3治疗胃酸过多 D.“地沟油”制取肥皂
难度: 简单查看答案及解析
-
一定温度下,满足下列条件的溶液一定呈酸性的是
A.pH=6的某溶液 B.加酚酞后显无色的溶液
C.能与金属Al反应放出H2的溶液 D.c(H+)>c(OH-)的任意水溶液
难度: 中等查看答案及解析
-
实验表明,相同温度下,液态纯硫酸的导电性强于纯水。下列关于相同温度下纯硫酸的离子积常数K和水的离子积常数Kw的关系正确的是( )
A.K>Kw B.K=Kw C.K>Kw D.无法比较
难度: 中等查看答案及解析
-
下列叙述中因果关系成立的是( )
A.因为氨水可以导电,所以NH3是电解质
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为加热后纯水的pH<7,所以升温可使水呈酸性
D.因为电解质溶于水后发生电离,所以电解质在溶液中的反应实质是离子间的反应
难度: 中等查看答案及解析
-
下列分子中,属于含有极性键的非极性分子的是( )
A.NH3 B.H2S C.P4 D.C2H4
难度: 中等查看答案及解析
-
寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量,以下分析错误的是
A.将化学能转化为热能
B.其发热原理与钢铁的吸氧腐蚀相同
C.铁作负极,电极反应为:Fe – 3e-= Fe3+
D.活性炭作正极,电极反应为:2H2O + O2+ 4e-=4OH-
难度: 中等查看答案及解析
-
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是
A.该反应的化学方程式为4NH3+3F2→ NF3+3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
难度: 中等查看答案及解析
-
将反应 4(NH4)2SO4===N2↑+ 6NH3↑+ 3SO2↑+ SO3↑+ 7H2O 的产物气体通入BaCl2溶液,下列判断正确的是
A.无沉淀生成 B.肯定没有BaSO3生成
C.得到的沉淀是纯净物 D.得到的沉淀是BaSO4和BaSO3组成的混合物
难度: 简单查看答案及解析
-
室温下有下列四种溶液:①0.1 mol/L氨水 ②0.1 mol/L NH4Cl溶液 ③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L ④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是
A.②③④① B.②①③④ C.③②④① D.③②①④
难度: 中等查看答案及解析
-
下列鉴别方法不可行的是( )
A.用水鉴别乙醇、甲苯和溴苯 B.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
C.用燃烧法鉴别乙醇、苯和四氯化碳 D.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
难度: 中等查看答案及解析
-
用下列装置不能达到实验目的的是
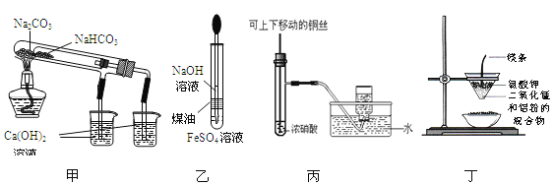
A.用甲图装置比较NaHCO3和Na2CO3的热稳定性
B.用乙图装置制备Fe(OH)2
C.用丙图装置制备并收集少量NO2气体
D.用丁图装置制取少量金属锰
难度: 中等查看答案及解析
-
把铁与铜的混合物放入稀硝酸中,反应后过滤,把滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的金属盐是
A.Cu(NO3)2
B.Fe(NO3)2
C.Fe(NO3)3
D.Fe(NO3)2和Cu(NO3)2
难度: 简单查看答案及解析
-
图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
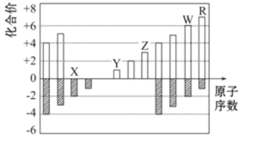
A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.25℃,12.0gNaHSO4固体中含有的阳离子数目为0.2NA
B.T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.2.24LN2和NH3混合气体中原子间含有的共用电子对数目为0.3NA
D.2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA
难度: 中等查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺如图:
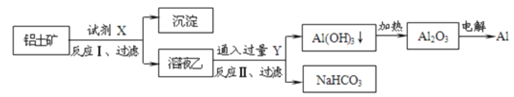
对上述流程判断正确的是( )
A.试剂X为稀硫酸或氢氧化钠溶液
B.反应II中生成Al(OH)3的反应为CO2+AlO2-+2H2O→Al(OH)3↓+HCO3-
C.结合质子(H+)的能力由强到弱的顺序是AlO2->OH->CO32->HCO3-
D.Al2O3熔点很高,工业上还可采用点解熔融AlCl3冶炼Al
难度: 中等查看答案及解析
-
某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列关于原溶液中离子成份的推测正确的是( )
A.一定有S2-、SO32-、Na+ B.可能只有Na+、S2-、CO32-
C.一定没有Ag+、Al3+ D.不可能只有Na+、S2-、NO3-
难度: 困难查看答案及解析
-
下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 = HCO3-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++ 2OH-+2HCO3-= CaCO3↓+ CO32-+ 2H2O
C.向0.2 mol溴化亚铁溶液中通入0.2 mol氯气:2Fe2++4Br-+3Cl2 = 2Fe3++6Cl-+2Br2
D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-= BaSO4↓+H2O
难度: 中等查看答案及解析