-
“保护环境,就是保护人类自己。”下列环境问题与产生的主要原因不相符的是( )
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“厄尔尼诺”现象是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的
⑦“赤潮”主要是由水体中P、N等元素过量引起的
A.只有①② B.只有②③⑤ C.全部 D.只有③
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L亚硫酸溶液中含有的H+离子数为2 NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
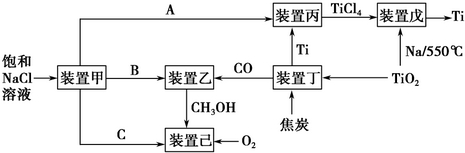
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )
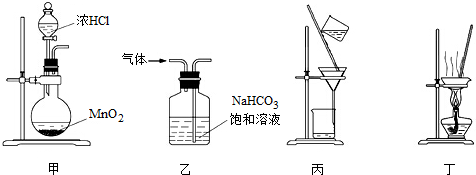
A.用装置甲制取氯气
B.用装置乙除去氯气中混有的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2•4H2O
难度: 中等查看答案及解析
-
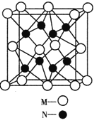
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
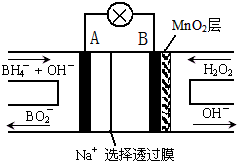
A.电极B为正极,纳米MnO2层的作用是提高原电池的工作效率
B.放电过程中,Na+从正极区向负极区迁移
C.电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12mol
难度: 困难查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A、碳酸氢钠溶液:c(Na+)+ c(H+)= c(CO32-)+ c(OH-)+ c(HCO3-)
B、物质的量浓度相等的CH3COOH和CH3COO Na 溶液等体积混合:c(CH3COOH)+ c(CH3COO-)=2 c(Na+)
C、硫酸铜溶液与过量浓氨水反应的离子方程式为:Cu2++ 2NH3•H2O= Cu(OH)2↓ +2 NH4+
D、一定浓度的盐酸和氨水混合可能出现c(Cl-)>c(NH4+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
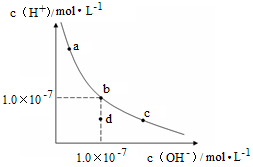
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
难度: 困难查看答案及解析