-
化学与生活密切相关,下列说法正确的是
A.硅酸钙可用于生产黏合剂和防火剂
B.改燃煤为燃气,可以减少废气中SO2等有害物质的排放量
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.发泡塑料饭盒适用于微波炉加热食品,不适于盛放含油较多的食品
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列叙述中正确的是( )
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,6.72 L NO2与水充分反应转移的电了数目为0.1NA
C.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D.100g 46%的乙醇溶液中,含H-O键的数目为7NA
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作
目的或结论
A
将Cu片放入FeCl3溶液中
证明Fe的金属性比Cu强
B
将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成
镁与CO2发生置换反应
C
将SO2通入溴水或酸性高锰酸钾溶液中
证明SO2有漂白性
D
向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液
除去FeCl2溶液中的FeBr2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于有机化合物的结构、性质的叙述正确的是( )
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“—OH”
难度: 中等查看答案及解析
-
世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是
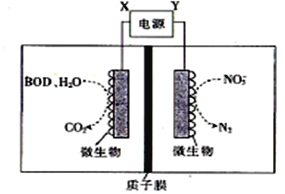
A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
难度: 困难查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是
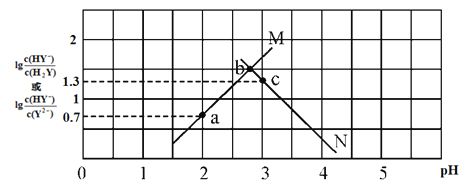
A. 曲线 M 表示 pH与 lg
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
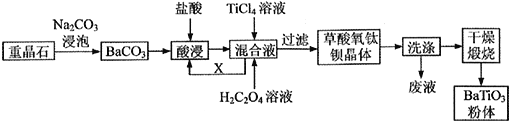
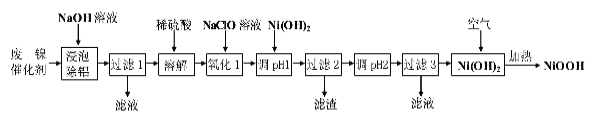
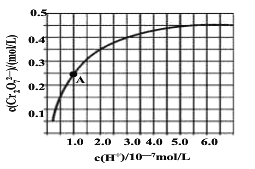
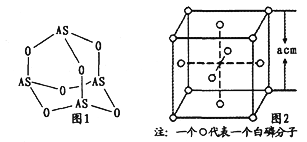
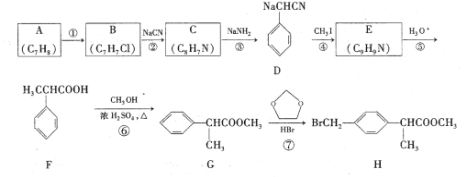
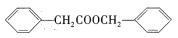 的合成路线。_______
的合成路线。_______