-
化学与生产、生活和技术等密切相关,下列说法正确的是( )
A.明矾和Fe2(SO4)3可作饮用水的净水剂和消毒剂
B.工业上用电解MgO、Al2O3的方法来冶炼对应的金属
C.高级脂肪酸乙酯是生物柴油的一种成分,这属于油脂
D.(肘后急备方)“青蒿一捏,以水二升渍,取绞汁”,该过程属于物理变化
难度: 简单查看答案及解析
-
有专家研究发现,有机物M(结构为
)可能是合成抑制新型冠状病毒药物的重要物质,下列关于M的说法正确的是( )
A.与乙烯互为同系物
B.所有碳原子可在同一平面上
C.一氯取代物有3种
D.可使酸性KMnO4溶液、溴水褪色,原理相同
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由其中两种上述元素组成的化合物,它们存在转化关系Q
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
A.原子半径:Y>Z>W>X
B.简单气态氢化物的热稳定性:Z>Y
C.物质M具有漂白性
D.Q既能与强酸溶液反应,又能与强碱溶液反应
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.0.2mol•L-1的MgCl2溶液中含Cl-数目为0.4NA
B.标准状况下,11.2LH2与11.2LD2所含的质子数均为NA
C.6.4gCu与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA
D.1LpH=1的H2SO4溶液中,含H+数目为0.2NA
难度: 简单查看答案及解析
-
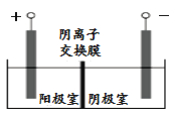
某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示,下列说法正确的是( )
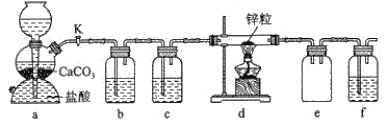
A.实验开始时,先点燃酒精灯,后打开活塞K
B.a中所发生反应的离子方程式是CO32-+2H+=CO2↑+H2O
C.b、c、f中试剂依次为饱和碳酸氢钠溶液、浓硫酸、银氨溶液
D.装置e的作用是收集一氧化碳气体
难度: 简单查看答案及解析
-
锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,该电池发生的总反应为2Li+P2VP·nI2
P2VP·(n-1)I2+2LiI。下列说法正确的是 ( )
A.该电池放电时,锂电极发生还原反应
B.该电池放电时,碘离子移向正极
C.P2VP和I2的复合物是绝缘体,不能导电,充电时与外电源的负极相连
D.放电时正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI
难度: 中等查看答案及解析
-
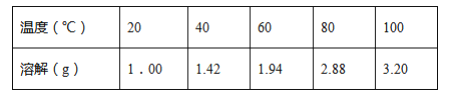
T℃时,在20.00mL0.10mol·L-1的一元酸HR溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。
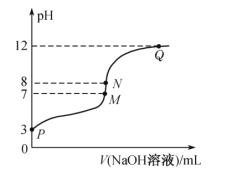
下列说法不正确的是( )
A..T℃时,HR电离常数Ka≈1.0×10-5
B.M点对应的NaOH溶液体积为20.00mL
C.N点与Q点所示溶液中水的电离程度:N>Q
D.M点所示溶液中c(Na+)=c(R-)
难度: 简单查看答案及解析


 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线如图,根据所学知识及题中信息,请将流程补充完成(无机试剂任选,格式按流程图)___。
的合成路线如图,根据所学知识及题中信息,请将流程补充完成(无机试剂任选,格式按流程图)___。