-
化学与环境、生产和生活密切相关,下列说法正确的是( )
A.腌制熟食品时,添加少量亚硝酸钠,是为了使其昧道更加美味可口
B.在煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
C.卫生部公告2011年5月1日起全面叫停面粉增白剂,由此可知:应当严格禁止在食品中使用任何食品添加剂
D.用氯气给自来水消毒可能生成对人体有害的有机氯化物难度: 中等查看答案及解析
-
设阿伏伽德罗常数为NA,下列叙述中完全正确的一组是( )
A.0.5mol/LBa(NO3)2溶液中,NO3-数目为NA
B.由Cu、Zn和稀硫酸组成的原电池中,若Cu极生成0.2gH2,则电路通过电子0.2NA
C.含2molH2SO4的浓硫酸与足量金属铜完全反应,产生SO2的数目为NA
D.22.4LCO和N2的混合气体中含有NA个气体分子难度: 中等查看答案及解析
-
以下关于有机物的说法中,正确的是( )
A.生活中食用的食醋、植物油、动物蛋白等物质是纯净物
B.淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体
C.石油的分馏主要是物理变化,而煤的干馏主要是化学变化
D.乙烯和聚乙烯中均含有不饱和碳碳双键难度: 中等查看答案及解析
-
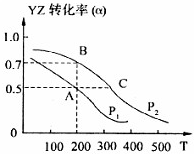
下列各图象中,不正确的是( )
A.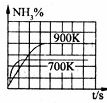
N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol
B.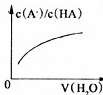
向弱酸HA的稀溶液中加水稀释
C.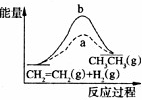
有催化剂(a)和无催化剂(b)时反应的能量变化
D.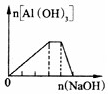
向NH4Al(SO4)2溶液中滴加过量NaOH溶液难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.碳酸氢钠在水中的电离:NaHCO3=Na++H++CO32-
B.AlCl3溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓
C.实验室保存氢氧化钠溶液不能用磨口玻璃塞:SiO2+2OH-=SiO32-+H2↑
D.CH3COOH是弱电解质,醋酸钠溶液显碱性是因:CH3COO-+H2OCH3COOH+OH-
难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.日本福岛核电站泄露的53131I与加碘盐中的53127I互为同位素
B.单原子形成的离子,一定与稀有气体原子的核外电子排布相同
C.L层上的电子数为奇数的原子一定是主族元素的原子
D.同一主族的元素的原子,最外层电子数相同,化学性质不一定完全相同难度: 中等查看答案及解析
-
下列说法正确的是( )
A.PH=13的溶液中Na+、Mg2+、Cl-、NO3-可以大量共存
B.PH值相等时①NH4Cl溶液②(NH4)2SO4③NH4HSO4三种溶液中,[NH4+]大小顺序为:①=②>③
C.等体积等浓度的氢氧化钠与醋酸混合后:[Na+]=[CH3COO-]
D.25℃时,Al(OH)3固体在20mL 0.0lmol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小难度: 中等查看答案及解析