-
化学与生活、生产、社会可持续发展密切相关,下列叙述正确的是
①煤的干馏和石油的分馏均属化学变化
②节能减排符合低碳经济的要求
③服用铬含量超标的药用胶囊会对人体健康造成危害
④田间焚烧秸秆
⑤合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
A.①③⑤ B.②③⑤ C.②③④ D.①②③
难度: 中等查看答案及解析
-
下列各组液体混合物中,能用分液漏斗分离的是( )
A.淀粉溶液和食盐溶液 B.乙醇和水
C.苯和溴苯 D.苯和水
难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述正确的是( )
A.乙醇、乙酸均能与Na反应放出氢气,二者分子中官能团相同
B.苯和油脂均不能使酸性KMnO4溶液褪色
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.纤维素和淀粉遇碘水均显蓝色
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是( )
A.同种元素的原子可以有不同的中子数
B.同主族元素从上到下,单质的熔点逐渐降低
C.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应的水化物的酸性越强
D.非金属元素组成的化合物中只含共价键
难度: 中等查看答案及解析
-
升高温度时,化学反应速率加快,主要原因为
A.分子运动速率加快,使该反应物分子的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热反应
D.该化学反应的过程是放热反应
难度: 中等查看答案及解析
-
下列化学式只代表一种物质的是( )
A.C5H12 B.C4H10 C.C2H6O D.C2H4
难度: 中等查看答案及解析
-
工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,则从经济效益考虑最合理的反应是( )
A.C3H8
3C+4H2
B.C3H8
C3H6+4H2
C.C3H8+6H2O
3CO2+10H2
D.
难度: 中等查看答案及解析
-
下列化工生产原理错误的是( )
①可以用电解熔融的氯化钠的方法来制取金属钠②可以用钠加入氯化镁饱和溶液中制取镁③用电解法制铝时,原料是氯化铝④炼铁高炉中所发生的反应都是放热的,故无需加热
A.②③ B.①③ C.①②③ D.②③④
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A.NH4Br的电子式:
B.CO2的结构式:
C.乙酸的分子式: CH3COOH D.乙烯的结构简式:CH2CH2
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A.将煤块磨成煤粉在“沸腾炉”中燃烧
B.Na与水反应时增大水的用量
C.FeCl3和NaOH两溶液反应时,增大压强
D.Fe与稀硫酸反应制取H2时,改为98%的浓硫酸
难度: 中等查看答案及解析
-
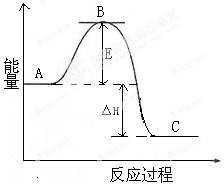
下列关于热化学反应方程式的描述正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2 CO2 (g)= 2CO(g)+O2(g)的反应的△H=+(2×283.0) kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
25℃、101kPa下:①2Na(s)+ 1/2O2(g)=Na2O(s) △H= -414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H= -511kJ·mol-1 下列说法正确的是( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s) △H= -317kJ·mol-1
D.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
难度: 中等查看答案及解析
-
把铝和氧化亚铁配成铝热剂,分为两等份,一份在高温下恰好完全反应,再与盐酸反应。另一份直接放入足量的烧碱溶液中充分反应,前后两种情况下生成的气体的质量比为( )
A.1︰1 B.3︰2 C.2︰3 D.28︰9
难度: 中等查看答案及解析
-
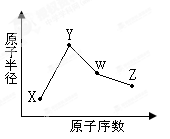
M、X、Y、Z、W是原子序数依次递增的短周期元素,其中X、Y、Z为同周期元素且最外层电子数之和为15,X与Z可形成XZ2分子,Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是M、X、Y、Z四种元素质子数之和的1/2。下列说法正确的是( )
A.原子半径:W >Z >Y >X>M
B.XZ2 、X2M2、W2Z2均为共价化合物
C.元素X与M形成的原子比为1︰1的化合物有多种
D.元素M、X的氯化物中,各原子均满足8电子的稳定结构
难度: 中等查看答案及解析
-
在一密闭容器中充入1 mol H2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g)=2HI(g) 下列说法正确的是( )
A.保持容器容积不变,向其中加入1molH2,化学反应速率不变
B.保持容器容积不变,向其中加入1molAr,化学反应速率增大
C.保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1molI2(g),化学反应速率不变
难度: 中等查看答案及解析
-
25℃和101kPa时,乙烷、乙炔(C2H2)组成的混合烃32mL与过量的氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,则原混合烃中乙烷的体积分数为( )
A.75% B.12.5% C.50% D.25%
难度: 中等查看答案及解析