-
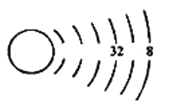
为了配合防疫,我们尽量做到每天测量体温,普通体温计中含有金属汞(Hg)。关于
Hg的说法正确的是
A.质子数为200 B.核外电子数为80
C.核电荷数为120 D.中子数为80
难度: 简单查看答案及解析
-
不同种元素的本质区别是
A.质子数不同 B.中子数不同
C.电子数不同 D.质量数不同
难度: 简单查看答案及解析
-
下列叙述中,错误的是
A.IIA元素在自然界中都以化合态存在
B.VA族元素都是非金属元素
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB10个纵列的元素都是金属元素
难度: 简单查看答案及解析
-
下列关于IVA元素形成的物质的叙述中,正确的是
A.金刚石和石墨互为同位素 B.石墨可用做绝缘材料
C.二氧化硅可用于制造光导纤维 D.硅酸的酸性强于碳酸
难度: 简单查看答案及解析
-
下列说法正确的是
A.阴阳离子间通过静电引力形成的化学键叫做离子键
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
难度: 简单查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有 1 个电子 B.H2O 与 D2O 互称同素异形体
C.1H 与 D 互称同位素 D.
与
的相对分子质量相同
难度: 中等查看答案及解析
-
关于离子化合物 NH5,下列说法正确的是
A.N 为-5 价 B.阴离子为8电子稳定结构
C.阴、阳离子个数比是 1:1 D.阳离子的电子数为 11
难度: 简单查看答案及解析
-
有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b,阴离子所带负电荷数c>d,则四种元素的原子序数关系是( )
A.a>b>c>d B.b>a>d>c C.c>b>a>d D.b>a>c>d
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
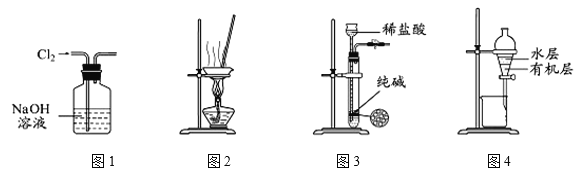
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 简单查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt不溶于水也不溶于稀硝酸
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.②④ B.①②③④
C.①③⑤ D.②④⑤
难度: 简单查看答案及解析
-
图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是

A.图甲横坐标为原子序数,纵坐标表示元素的最高正价
B.图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C.图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D.图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、W2Z2均为共价化合物
C.由X元素形成的单质硬度一定很大
D.由X、Y、Z、M四种元素形成的化合物可能既有离子键,又有共价键
难度: 简单查看答案及解析