-
纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。納米级Fe3O4有多种不同制法,请回答下列相关问题。
I.下图是用共沉淀法制备纳米四氧化三铁的流程。
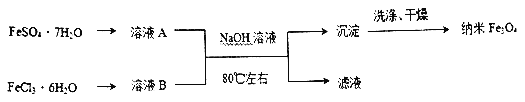
(1)除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是___(填化学式),该物质的用途是___ (任写一种)。
(2)实验室保存溶液B 时为了防止出现浑浊通常采用的措施是___。
(3)证明沉淀已经洗涤干净的操作是_________ 。
(4)写出该方法中发生的主要反应的离子方程式___________ 。
(5)实际生产中为提高产率,起始所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1:2,原因是______。
II.制备纳米四氧化三铁的另一种流程如下图所示。
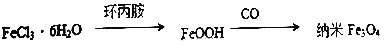
(6)写出第2 步反应的化学方程式______________,其中氧化产物和还原产物的物质的量之比为______。
(7)纳米Fe3O4投入分散剂中形成的分散系是______________。
-
硅在地壳中的含量较高,在自然界中硅主要以硅的氧化物和硅酸盐的形式存在。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。下图为一种工业上提纯硅的路线:
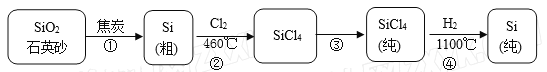
相关信息如下:
a.硼、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | FeCl3 | PCl5 | Si | SiH4 |
| 沸点/℃ | 57.7 | 12.8 | 315 | — | 2355 | -111.9 |
| 熔点/℃ | -70.0 | -107.2 | — | — | 1410 | — |
| 升华温度/℃ | — | — | 300 | 162 | — | — |
请回答下列问题:
(1)SiCl4的电子式:________________;
(2)写出①的化学方程式________________________________________;
(3)①SiO2是硅酸盐玻璃的主要成分,盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,写出发生反应的离子方程式 ______________________________________________________________
②硅能与NaOH溶液反应,但同主族元素金属锗(Ge)不易溶于NaOH溶液,但有H2O2存在时,锗能与NaOH溶液反应生成锗酸盐,请写出化学反应方程式 ______________________________________________________________
(4)用强还原剂LiAlH4在乙醚介质中还原SiCl4,制得高纯度的甲硅烷SiH4,SiH4极易水解生成SiO2·nH2O和另一种气体。写出SiH4水解的化学反应方程式 __________________________________________________________________
(5)下列有关含硅材料说法正确的是_______________ (填字母)
A. 沸点:SiCl4 > SiH4
B. 金刚砂的有效成分是氮化硅,硬度大、熔点高,可用于制作高温陶瓷和轴承
C. 玻璃、陶瓷、水泥是广泛使用的三大新型硅酸盐材料
D. 人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂等。
E. 锗、锡、铅的+4价氢氧化物的碱性强弱顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4
(6)粗硅中常含有铁、硼、磷等杂质,步骤②需在无氧无水环境下,控制温度在460℃左右得到SiCl4粗品,欲提纯SiCl4,步骤③采用的工艺方法依次是沉降、冷凝和_____________,需收集温度在_________℃左右的馏分。
-
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
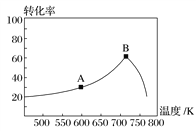
A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
-
X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
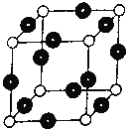
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
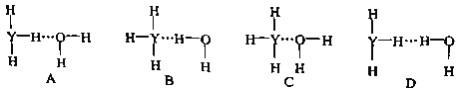
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
-
丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图所示:
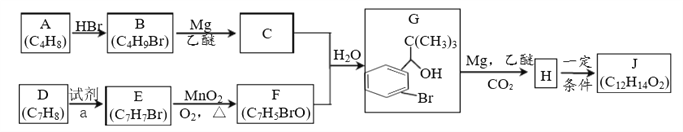
已知:
(1)A的名称是_______;E到F的反应类型是___________。
(2)试剂a是________,F中官能团名称是_______。
(3)E的含苯环同分异构体共有______种(不含E)。
(4)J是一种酯,分子中除苯环外还含有一个五元环,J的结构简式为__________-。H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为________。
(5)利用题中信息写出以乙醛和苯为原料,合成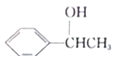 的路线流程图(其它试剂自选)。____________
的路线流程图(其它试剂自选)。____________
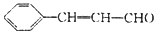 ),杏仁含苯甲醛(
),杏仁含苯甲醛()。下列说法错误的是







 的路线流程图(其它试剂自选)。____________
的路线流程图(其它试剂自选)。____________