-
下列化学用语或图示表达不正确的是( )
A.CO2的电子式:
B.NH3的结构式为:
C.CH4的比例模型:
 D.Clˉ离子的结构示意图:
D.Clˉ离子的结构示意图:难度: 简单查看答案及解析
-
已知R2+核内共有N个中子,R的质量数为A,m g R2+中含电子的物质的量为( )
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
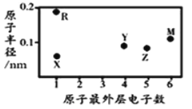
A.简单阳离子半径X最小
B.M的氢化物常温常压下为气体,分子间无氢键
C.最高价氧化物的水化物的酸性:Z<Y
D.X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
难度: 中等查看答案及解析
-
某同学设计如下元素同期表,以下说法正确的是

A. 白格中都是主族元素,灰格中都是副族元素
B. X、Y、Z元素分别为N、P、O
C. 原子半径:Z>X>Y
D. X、Y、Z的气态氢化物中稳定性最高的是X的氢化物
难度: 中等查看答案及解析
-
下列关于元素金属性、非金属性的说法正确的是 ( )
A.HCl的酸性强于H2S,故非金属性Cl>S
B.ⅠA族金属元素是同周期中金属性最强的元素
C.仅用AlCl3、MgCl2、NaOH三种溶液,无法验证Mg、Al的金属性强弱
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素Y能与元素Z形成化合物Z2Y2,该化合物内部有两种化学键
C.元素Y、R分别与元素X形成的化合物的沸点XmY<XmR
D.元素W、R的最高价氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
下列物质间的反应,其能量变化符合如图的是( )
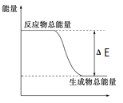
A.碳酸钙的分解
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.铝热反应
难度: 简单查看答案及解析
-
根据下面的信息,下列叙述正确的是( )
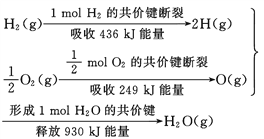
A.2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B.化学反应中能量变化的大小与反应物的质量多少无关
C.1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D.2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
难度: 中等查看答案及解析
-
由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( )
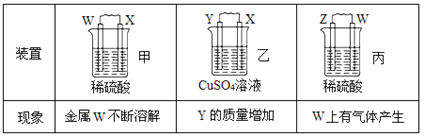
A.装置甲中W作原电池负极 B.装置乙中Y电极上的反应式为Cu2++2e−=Cu
C.装置丙中溶液的c(H+)不变 D.四种金属的活动性强弱顺序为Z>W>X>Y
难度: 中等查看答案及解析
-
H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述不正确的是( )
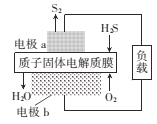
A.电池工作时,化学能转化为电能和热能
B.电极b上发生的电极反应式为O2+ 4e−+4H+=2H2O
C.a是负极,电池工作时,电子的流动方向是:电极a→负载→电极b→质子膜→电极a
D.当电路中通过4mol电子时,有4molH+经质子膜进入正极区
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用铁片和稀硫酸制取H2时,为增大反应速率,可以将硫酸改为98%的硫酸
B.在反应C+CO2
2CO中,若v (CO)为1 mol•L-1•min-1,则v(C)为0.5 mol•L-1•min-1
C.决定化学反应速率的主要因素为反应温度
D.盐酸与K2CO3粉末反应时,将盐酸的浓度增大一倍,用量减半,可以加快反应速率
难度: 中等查看答案及解析
-
对于可逆反应4NH3+5O2
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.反应达到平衡时,反应物的转化率一定小于100%
难度: 困难查看答案及解析
-
在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)
Y(g)+Z(s) (乙)A(s)+2B(g)
C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度;②反应容器中生成物的百分含量;③反应物的消耗速率与生成物的消耗速率之比等于系数之比;④混合气体的压强⑤混合气体的总物质的量。其中能表明(甲)和(乙)都达到化学平衡状态是( )
A.①②③ B.①②③⑤ C.①②③④ D.①②③④⑤
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.CH4的二氯代物只有一种,此事实可说明CH4为正四面体结构
B.光照条件下,1 mol甲烷和氯气完全取代需要2 mol氯气
C.C6H14的同分异构体有4种
D.正戊烷和异戊烷属于同系物
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.乙烯的球棍模型为
B.CH2=CH—CH3分子中,最多有7个原子共面
C.用溴水或酸性KMnO4溶液可以区分甲烷和乙烯,也可以除去甲烷中的乙烯杂质得到纯净甲烷
D.C2H4和SO2都能使溴水褪色,又能使酸性KMnO4溶液褪色,并且化学反应原理相同
难度: 困难查看答案及解析
-
烷烃
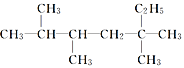 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有A.4种 B.5种 C.6种 D.7种
难度: 简单查看答案及解析




