-
W、X、Y、Z为原子序数依次增大的短周期主族元素,W的原子核外只有6个电子,X+和Y3+的电子层结构相同,Z-的电子数比Y3+多8个,下列叙述正确的是
A.W在自然界只有一种核素 B.半径大小:X+>Y3+>Z-
C.Y与Z形成的化合物的水溶液呈弱酸性 D.X的最高价氧化物对应的水化物为弱碱
难度: 困难查看答案及解析
-
ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是
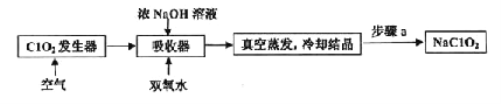
A.通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑
C.步骤a的操作包括过滤、洗涤和干燥
D.工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol金刚石中含有2NA个C-C键,1mol SiO2含有2NA个Si-O键
B. 标况下,将9.2g甲苯加入足量的酸性高锰酸钾溶液中转移的电子数为0.6NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 标准状况下,22.4 L庚烷中所含的分子数约为NA
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A.除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
B.CH3CH2CH2COOH和CH3COOCH2CH3属于碳链异构
C.除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D.一个苯环上已经连有—CH3、—CH2CH3、—OH三种基团,如果在苯环上再连接一个—CH3,其同分异构体有16种
难度: 中等查看答案及解析
-
下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是
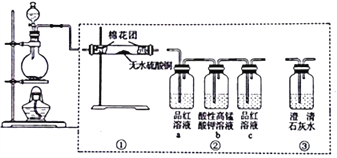
A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
难度: 中等查看答案及解析
-
某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是
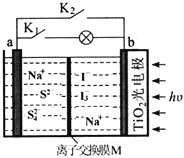
A.充电时,太阳能转化为电能,又转化为化学能
B.放电时,a极的电极反应式为:4S2--6e-=S42-
C.充电时,阳极的电极反应式为:3I--2e-=I3-
D.M是阴离子交换膜
难度: 中等查看答案及解析
-
向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是
A.向电解液中加入稀硫酸,有利于Cl-的去除
B.溶液pH越大,Ksp(CuCl)增大
C.反应达到平衡增大c(Cu2+),c(Cl—)减小
D.1/2 Cu(s)+ 1/2 Cu2+(aq)+Cl—(aq)
CuCl(s) ΔH=(a+2b) kJ·mol-1
难度: 困难查看答案及解析






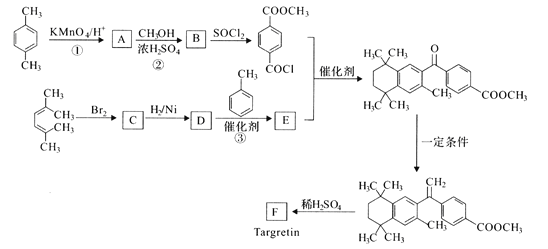
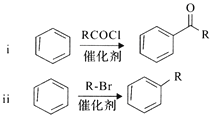
 (R表示烃基或芳基)
(R表示烃基或芳基)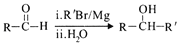 (R、R’为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R’为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成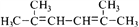 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。