-
化学与生产生活密切相关。下列说法正确的是
A.阻燃剂Al(OH)3受热分解时放出能量
B.蚕丝、涤纶、棉花的主要成分均为蛋白质
C.油脂在长期贮存过程中与微生物、酶和空气中的氧气作用会发生酸败
D.硅太阳能电池与铜锌原电池工作时均由化学能转变为电能
难度: 简单查看答案及解析
-
下列说法正确的是
A. 1mol萘(
)含有5mol碳碳双键
B. CH3CH=CHCH3 分子中的所有原子处于同一平面
C. 可用溴水鉴别苯、四氯化碳、酒精
D. 尿素[CO(NH2)2]的含氮质量分数比碳酸氢铵的低
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.标准状况下,11.2L14CO2含有的中子数为11NA
B.5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C.1molNa2O2固体中所含离子数目为4NA
D.1LpH=6的纯水中含有OHˉ的数目为10-8NA
难度: 困难查看答案及解析
-
某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是
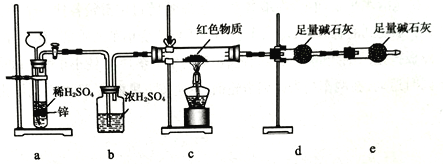
A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
难度: 中等查看答案及解析
-
如图所示的C/Na4Fe(CN)6--钠离子电池是一种新型电池。下列有关说法正确的是
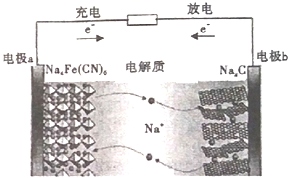
A. 电极a在放电时做正极,充电时做阴极
B. 放电时,电极b上的电极反应为:NaxC-e-=Na++Nax-1C
C. 电池工作时,Na+向电板b移动
D. 该电池通过Na+的定向移动产生电流,不发生氧化还原反应
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u为形成酸雨的主要物质之一;25℃时,0.01mol/L的v溶液中pH=== 12。上述物质的转化关系如图所示。下列说法正确的是
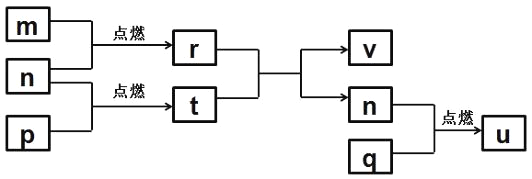
A.原子半径的大小: W>Z>Y>X
B.v能抑制水的电离而u能促进水的电离
C.粘有q的试管可用酒精洗涤
D.Z分别与Y、W组成的化合物中化学键类型可能相同
难度: 中等查看答案及解析
-
已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。下列说法不正确的是( )
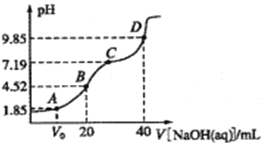
A.A点所得溶液中:Vo等于l0mL
B.B点所得溶液中:c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
C.C点所得溶液中:c(Na+)>3c(HSO3-)
D.D点所得溶液中水解平衡常数:Kh1=10-6.81
难度: 困难查看答案及解析
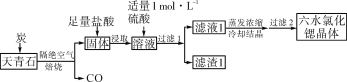





 的线路图。________
的线路图。________