-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,W是原子半径最大的短周期元素。下列判断正确的是( )
A.最高价含氧酸酸性:X<Y B.X、Y、Z可形成离子化合物
C.W可形成双原子分子 D.M与W形成的化合物含极性共价键
难度: 中等查看答案及解析
-
我国是世界最大的耗煤国家,下列加工方法不属于煤的综合利用的是
A.干馏 B.气化 C.液化 D.裂解
难度: 简单查看答案及解析
-
下列物质中含有非极性键的共价化合物是
A.CCl4 B.Na2O2 C.C2H4 D.CS2
难度: 简单查看答案及解析
-
如图是元素周期表中关于碘元素的信息,其中解读正确的是
A.碘元素的质子数为53
B.碘原子的质量数为126.9
C.碘原子核外有5种不同能量的电子
D.碘原子最外层有7种不同运动状态的电子
难度: 简单查看答案及解析
-
可确定乙二醇分子是否有极性的实验是
A.测定沸点 B.测静电对液流影响
C.测定蒸气密度 D.测标准状况下气体摩尔体积
难度: 简单查看答案及解析
-
美国《Science》杂志曾经报道:在40 GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰。有关原子晶体干冰的推断错误的是
A.有很高的熔点和沸点 B.易汽化,可用作制冷材料
C.含有极性共价键 D.硬度大,可用作耐磨材料
难度: 简单查看答案及解析
-
我们熟知的一些化合物的应用错误的是
A.MgO冶炼金属镁 B.NaCl用于制纯碱
C.Cu(OH)2用于检验糖尿病 D.FeCl3用于净水
难度: 中等查看答案及解析
-
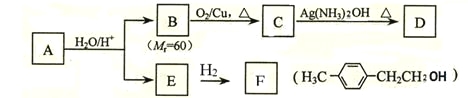
是制作电木的原料。下列围绕此物质的讨论正确的是
A.该有机物没有确定的熔点 B.该有机物通过加聚反应得到
C.该有机物通过苯酚和甲醇反应得到 D.该有机物的单体是 -C6H3OHCH2-
难度: 简单查看答案及解析
-
甲醇低压羰基合成法(CH3OH+CO→CH3COOH)是当今世界醋酸生产的主要方法,国标优等品乙酸含量
99.8%。为检验得到的乙酸中是否含有甲醇,可用的方法是
A.观察放入金属Na是否产生气泡
B.观察滴入的紫色石蕊溶液是否变红
C.观察滴入的酸性KMnO4溶液是否褪色
D.观察插入的表面发黑的灼热铜丝是否变红
难度: 简单查看答案及解析
-
为了实现绿色化学,符合工业生产实际的是
A.用纯碱吸收硫酸工业的尾气 B.用烧碱吸收氯碱工业的尾气
C.用纯碱吸收合成氨工业的尾气 D.用烧碱吸收炼铁工业的尾气
难度: 简单查看答案及解析
-
工业上以CaO和HNO3为原料制备Ca(NO3)2•6H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为
A.53.8% B.58.3% C.60.3% D.70.0%
难度: 简单查看答案及解析
-
在化学能与电能的转化中,下列叙述正确的是
A.镀锌铁皮在食盐水中发生析氢腐蚀
B.电解池的阴极材料一定比阳极材料活泼
C.将铁器与电源正极相连,可在其表面镀锌
D.原电池的负极和电解池的阳极均发生氧化反应
难度: 简单查看答案及解析
-
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)
3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
A.H2S是还原剂
B.脱除H2S的反应是放热反应
C.温度越高H2S的脱除率越大
D.压强越小H2S的脱除率越高
难度: 中等查看答案及解析
-
常温常压下,下列气体混合后压强一定不发生变化的是
A.NH3和Cl2 B.NH3和HBr C.SO2和O2 D.SO2和H2S
难度: 简单查看答案及解析
-
以下实验原理或操作中正确的是
A.焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀H2SO4洗净并灼烧
B.制备氢氧化铜悬浊液时,向10%NaOH溶液中滴入少量2%CuSO4溶液
C.配制浓H2SO4、浓HNO3混合酸时,首先向试管里放入一定量浓H2SO4
D.上升纸层析实验中,将试液点滴浸没在展开剂里,静置观察
难度: 中等查看答案及解析
-
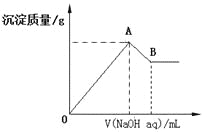
化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是
①
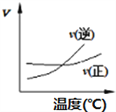 ②
② ③
③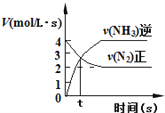 ④
④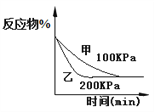
A.A2(g)+ 3B2(g)
2AB3(g),如图①说明此反应的正反应是吸热反应
B.4CO(g) +2NO2(g)
N2(g)+4CO2(g) ,如图② 说明NO2 的转化率b>a>c
C.N2(g)+ 3H2(g)
2NH3(g),如图③说明t秒时合成氨反应达到平衡
D.2A(g)+2B(g)
3C(g)+D(? ),如图④说明生成物D一定是气体
难度: 中等查看答案及解析
-
黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①2Cu2O+Cu2S→6Cu+SO2…②.则
A.反应①中还原产物只有SO2
B.反应②中Cu2S只发生了氧化反应
C.将1 molCu2S冶炼成 2mol Cu,需要O21mol
D.若1molCu2S完全转化为2molCu,则转移电子数为2NA
难度: 中等查看答案及解析
-
下列实验目的能实现的是
A.实验室制备乙炔
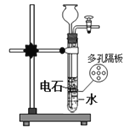 B.实验室制备氢氧化亚铁
B.实验室制备氢氧化亚铁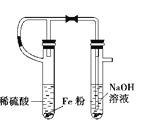 C.实验室制取氨气
C.实验室制取氨气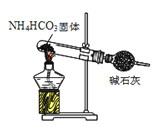 D.实验室制取乙酸丁酯
D.实验室制取乙酸丁酯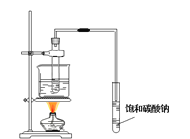
难度: 中等查看答案及解析