-
下列数字代表各元素的原子序数,则各组中相应的元素能形成XY2型共价化合物的是
A. 3和8 B. 1和16 C. 12和17 D. 6和16
难度: 中等查看答案及解析
-
反应NH4Cl+NaNO2
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:
B. N2的结构式:N=N
C. Na+的结构示意图:
D. H2O的电子式:
难度: 简单查看答案及解析
-
下列各组中的性质比较,不正确的是( )
A.稳定性:NH3<PH3<SiH4 B.酸性:HClO4>H2SO4>H3PO4
C.碱性:KOH>NaOH>Mg(OH)2 D.还原性:F-<Cl-<Br-
难度: 中等查看答案及解析
-
下列各组化合物中,化学健的类型完全相同的是
①CaCl2 和Na2S ②Na2O 和Na2O2 ③CO2 和CS2 ④HCl 和NaOH
A.①② B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
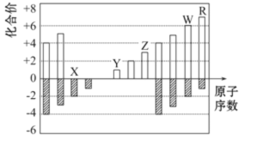
A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
有关化学键的断裂和形成,下列说法正确的是( )
A. 氢气在氧气中燃烧时,存在化学键的断裂和形成
B. 有化学键断裂的过程一定是化学变化
C. 化学反应过程中,反应物中所有的化学键都要断裂
D. 干冰升华时,分子中的共价键发生断裂
难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次递增的短周期元素,3 种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z 与 X 形成化合物的沸点高于Z 的同族元素与 X形成化合物的沸点
C.CaY2 与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2 等3种化合物中,阳离子与阴离子个数比均为 1∶2
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
难度: 中等查看答案及解析
-
X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )
A.只含极性键的共价化合物
B.含非极性键的共价化合物
C.阴阳离子个数之比为1∶1的离子化合物
D.可形成双核离子或者四核离子
难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )。
A.元素A、B组成的最简单化合物中各原子都为8电子稳定结构
B.元素C、D的最高价氧化物对应的水化物之间不能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE含有相同类型的化学键
难度: 中等查看答案及解析
-
化学键使得一百多种元素构成了世界的万事万物.关于化学键的下列叙述中,正确的是:
A. 离子化合物一定含有共价键,共价化合物中不含离子键
B. 共价化合物可能含离子键,离子化合物中只含离子键
C. 构成单质分子的粒子一定含有共价键
D. 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
难度: 中等查看答案及解析
-
固体A的化学式为NH5,其所有原子的最外电子层结构都符合相应稀有气体元素原子的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5NA个N—H键(设NA表示阿伏加德罗常数的值)
B.NH5中既有共价键又有离子键
C.NH5的电子式为
D.NH5与水反应的离子方程式为NH4++H-+H2O=NH3·H2O+H2↑
难度: 困难查看答案及解析