-
环保问题一直是社会的热门话题。下列相关叙述中错误的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.利用太阳能等新能源代替化石燃料
C.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D.含次氯酸盐的漂水与含盐酸的洁厕灵混合使用会产生有毒气体
难度: 简单查看答案及解析
-
下列表达正确的是
A.氟原子中能量最髙的电子其电子云图:
B.CO2的分子模型示意图:

C.2-甲基丁醛的结构简式:
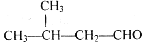
D.N2的结构式::N≡N:
难度: 简单查看答案及解析
-
放射性元素碘131(
)和铯137(
)是核反应物中的主要元素。下列叙述正确的是
A.
与
的所有性质都相同
B.
原子中含有中子数比质子数多27
C.
与
的中子数相同
D.
与
是同素异形体
难度: 简单查看答案及解析
-
在下列变化过程中,被破坏的作用力正确的是( )
A. 干冰升华——共价键 B. 二氧化硅熔融——范德华力
C. 氢氧化钠熔融——离子键、共价键 D. 硫酸氢钠溶于水——离子键、共价键
难度: 简单查看答案及解析
-
下列关于相关反应的叙述错误的是
A.硫化钠溶液中通入硫化氢气体不发生化学反应
B.向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解
C.将少量氯气通入碘化亚铁和淀粉混合溶液,溶液变蓝
D.硫化亚铁加入稀硫酸后可以产生硫化氢气体
难度: 中等查看答案及解析
-
下列关于NH4+与CH4的相关数目比较前者大于后者的是
A.电子数 B.化学键数 C.质子数 D.原子数
难度: 简单查看答案及解析
-
下列反应中,浓硫酸既表现出强氧化性又表现出酸性的是( )
A.2NaCl+H2SO4(浓)
Na2SO4+2HCl↑
B.Na2SO3+H2SO4(浓)
Na2SO4+SO2↑+H2O
C.C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
D.2FeO+4H2SO4(浓)
Fe2(SO4)3+SO2↑+4H2O
难度: 简单查看答案及解析
-
有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
第一组
A -268.8
B -249.5
C -185.8
D -151.7
第二组
F2 -187.0
Cl2 -33.6
Br2 58.7
I2 184.0
第三组
HF 19.4
HCl -84.0
HBr -67.0
HI -35.3
第四组
H2O 100.0
H2S -60.2
H2Se -42.0
H2Te -1.8
下列各项判断正确的是
A. 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强
B. 第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se
C. 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI
D. 第一组物质是分子晶体,一定含有共价键
难度: 中等查看答案及解析
-
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图,其中电解池中隔膜仅阻止气体通过,阴、阳极均为石墨电极。下列相关叙述正确的是
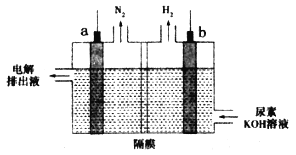
A.b电极为阳极
B.电子由b电极经过溶液流入a电极形成回路
C.b电极上发生失去电子的反应
D.尿素在a电极发生氧化反应
难度: 中等查看答案及解析
-
聚乳酸的结构为
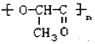 有机物的相关叙述正确的是
有机物的相关叙述正确的是A.其单体不能发生消去反应
B.其单体可以通过反应形成六元环状化合物
C.其单体含有
D.聚乳酸是由加聚反应获得
难度: 中等查看答案及解析
-
对于某酸性溶液(可能含有Br-、SO42-、HSO3-、NH4+),分别进行如下实验:①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色;④加入BaCl2液和稀硝酸,产生不溶于稀硝酸的白色沉淀。对于下列微粒不能确定其在原溶液中是否存在的是
A.Br- B.SO42- C.HSO3- D.NH4+
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A.水电离出的c(OH-)=0.001mol/L的溶液:H+、Fe2+、Cl-、SO42-
B.c(H+)=0.001mol/L的溶液:NH4+、Ba2+、A1O2-、Cl-
C.pH=12的溶液:K+、Fe2+、ClO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、NH4+、Cl-、NO3-
难度: 中等查看答案及解析
-
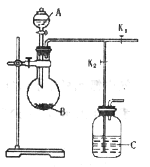
关于下列各实验装置的叙述中,错误的是
A.
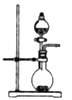 装置可用于实验室制取少量O2
装置可用于实验室制取少量O2B.
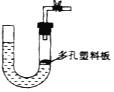 不用其它装置就可以检验装置的气密性
不用其它装置就可以检验装置的气密性C.
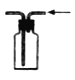 按图示气流方向实验室可用装置收集HCl
按图示气流方向实验室可用装置收集HClD.
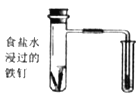 装置用于研究铁的吸氧腐蚀实验
装置用于研究铁的吸氧腐蚀实验难度: 简单查看答案及解析
-
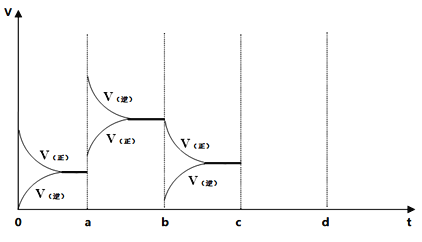
在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)⇌2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
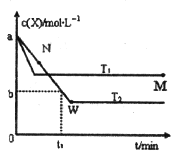
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0〜t1时间内,υ(Y)=
C.M点的平衡常数比W点的平衡常数小
D.M点时再加入一定量的X,平衡后X的转化率增大
难度: 中等查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
Cl2
FeBr3
Cl-
②
KClO
浓盐酸
Cl2
③
KMnO4
H2O2
H2SO4
O2
Mn2+
A.第③组反应的离子方程式为:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
B.第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存
C.氧化性强弱的比较:KClO < Cl2
D.第①组的反应只可能有一种元素被氧化
难度: 中等查看答案及解析
-
表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,104 g苯乙烯中含有的碳碳双键数为NA
B.5.6克铁与足量盐酸反应,转移0.3NA个电子
C.2mol的甲基(-CH3)所含电子数为14NA
D.标准状况下,22.4L辛烷完全燃烧生成二氧化碳分子数为8NA
难度: 中等查看答案及解析
-
向80mL 0.1mol•L-1稀HNO3溶液中加入铜粉和铁粉混合物,固体完全溶解,在反应后溶液中滴加硫氰化钾溶液,溶液没有出现血红色。铜粉和铁粉混合物的质量可能是
A.0.168g B.0.184g C.0.192g D.0.200g
难度: 困难查看答案及解析
-
向NaHCO3和Na2CO3的混合液中逐滴加入Ba(OH)2溶液。下列离子方程式与事实不符的是
A.OH-+HCO3-+Ba2+=BaCO3↓+H2O
B.CO32-+Ba2+=BaCO3↓
C.2OH-+2HCO3-+Ba2+=BaCO3↓+CO32-+H2O
D.OH-+HCO3-=H2O+CO2
难度: 中等查看答案及解析
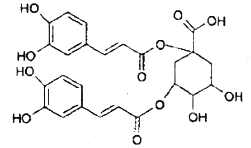
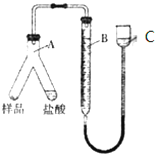
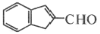 ,具体合成途径如下:
,具体合成途径如下: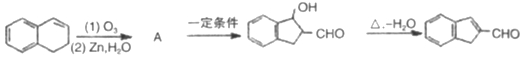
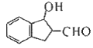 的一种同分异构体是一种芳香酸,且分子只含有一个环,写出满足条件的任意一种同分异构体的结构简式__________
的一种同分异构体是一种芳香酸,且分子只含有一个环,写出满足条件的任意一种同分异构体的结构简式__________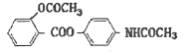 ,其合成途径如下:
,其合成途径如下: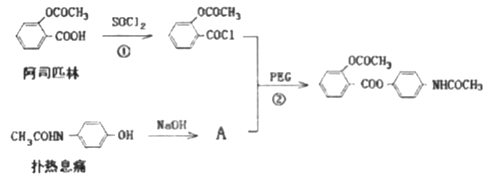
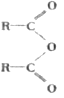 +R'OH
+R'OH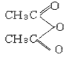 )为有机原料,合成阿司匹林,请设计完成下列合成途径______(合成路线常用的表示方法为:A
)为有机原料,合成阿司匹林,请设计完成下列合成途径______(合成路线常用的表示方法为:A