-
某溶液中含有HCO3-、SO32-、CO32-、CH3COO-4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
A.CH3COO- B.SO32-
C.CO32- D.HCO3-
难度: 简单查看答案及解析
-
某元素原子价电子排布式为3d54s2,下列说法错误的是( )
A.该元素位于周期表第四周期ⅦB族 B.该元素的最高化合价为+7价
C.该元素的化合物常用作催化剂 D.该元素位于周期表ds区
难度: 简单查看答案及解析
-
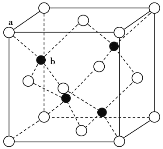
如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
X
Y
Z
W
A.X、Z形成的二元化合物属于原子晶体
B.Z、X、W三种元素的氧化物对应水化物的酸性依次增强
C.由X、W和氢三种元素形成的化合物中只含共价键
D.X、Y、W三种元素最低价氢化物的沸点依次升高
难度: 中等查看答案及解析
-
汽车尾气无害化处理反应为2NO(g)+2CO(g)
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A.升高温度可使该反应的正反应速率增大,逆反应速率减小
B.增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C.该反应反应物总能量小于生成物总能量
D.使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
D.室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+
难度: 简单查看答案及解析
-
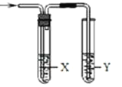
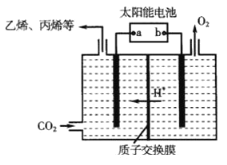
ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )

A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
难度: 中等查看答案及解析
-
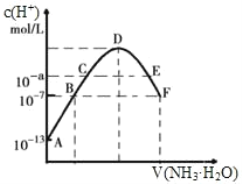
室温下,用0.100mol·L−1的NaOH溶液分别滴定均为20.00mL0.100mol·L−1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
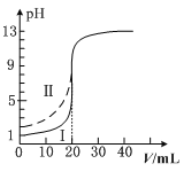
A.Ⅰ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)
Sn(s,白) △H3=+2.1kJ•mol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
难度: 中等查看答案及解析
-
25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质
AgCl
AgBr
AgI
Ag2S
颜色
白
淡黄
黄
黑
Ksp
1.8×10-10
7.7×10-13
1.5×10-16
1.8×10-50
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
难度: 困难查看答案及解析
-
下列反应中,改变反应物的用量或者浓度不会改变反应产物的是
A.硫粉在空气中燃烧 B.澄清石灰水和碳酸氢钠溶液反应
C.锌粉加入到
溶液 D.氯气通入
溶液中
难度: 中等查看答案及解析