-
下列各组属于同位素的是 ( )
A. 金刚石和石墨 B. 苏打和小苏打 C. 614C和612C D. O2和O3
难度: 简单查看答案及解析
-
下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱
C.酸性H2CO3>H2SiO3,判断碳与硅的非金属活动性强弱
D.Br2与I2分别与足量的H2反应的难易,判断溴与碘的非金属活动性强弱
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. CaCl2晶体中存在共价键
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
C. SiO2属于原子晶体,熔化破坏共价键和分子间作用力
D. I2是分子晶体,加热升华过程中只需克服分子间作用力
难度: 中等查看答案及解析
-
ETH天文研究报道称组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A.20Ne和22Ne互为同位素 B.20Ne和22Ne互为同素异形体
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
难度: 简单查看答案及解析
-
下列与有关非金属元素叙述以及推理结果不正确的是( )
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为F2+2Cl-=Cl2+2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>As,故前者的气态氢化物稳定性更强
④非金属性O>N,故O2与H2化合比N2更容易
A. ②③ B. ③④ C. ①④ D. ①②
难度: 简单查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt不溶于水也不溶于稀硝酸
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.②④ B.①②③④
C.①③⑤ D.②④⑤
难度: 简单查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、W2Z2均为共价化合物
C.由X元素形成的单质硬度一定很大
D.由X、Y、Z、M四种元素形成的化合物可能既有离子键,又有共价键
难度: 简单查看答案及解析
-
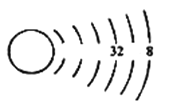
为了配合防疫,我们尽量做到每天测量体温,普通体温计中含有金属汞(Hg)。关于
Hg的说法正确的是
A.质子数为200 B.核外电子数为80
C.核电荷数为120 D.中子数为80
难度: 简单查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
难度: 简单查看答案及解析
-
一个氯原子的质量是ag,12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是( )
A.氯元素的相对原子质量为
B.mg该氯原子的物质的量一定是
mol
C.该氯元素的摩尔质量是aNA
D.ng该氯原子所含的电子数为
难度: 简单查看答案及解析
-
化学实验设计和操作中必须十分重视安全问题和环保问题。下列实验方法或实验操作不正确的有( )
①用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中;
②进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大;
③水和碘的四氯化碳溶液分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出;
④进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热;
⑤酒精着火时可用湿抹布或沙土扑火;
⑥进行SO2性质实验时要在通风橱内进行,多余的SO2一律排到室外;
⑦做实验时可用手直接拿取金属钠;
⑧夜间发生厨房煤气泄漏,应立即开灯检查煤气泄漏的原因,并打开所有门窗通风;
⑨不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗。
A.5个 B.6个 C.7个 D.8个
难度: 中等查看答案及解析
-
图中的数字代表的是原子序数,图中数字所表示的元素与它们在元素周期表中的实际位置相符的是( )
A.
 B.
B. C.
D.
难度: 中等查看答案及解析