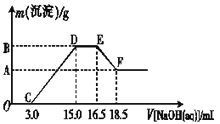
-
名句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别指
A.纤维素 脂肪 B.蛋白质 液态烃
C.淀粉 油脂 D.纤维素 动物油
-
下列行为不符合“促进低碳经济”宗旨的是( )
A.尽量使用含12C的产品,减少使用含13C或14C的产品
B.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
-
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.海水中含有溴元素,只需经过物理变化就可以得到溴单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D.利用潮汐发电是将化学能转化为电能
-
水是最宝贵的资源之一。 下列表述正确的是
A.H2O的电子式为
B.273K、101kPa,水的分子间距离:d(气态)>d(液态)>d(固态)
C.4℃时,纯水的pH=7
D.D216O中,质量数之和是质子数之和的两倍
-
以下表示碳原子结构的化学用语中,对电子运动状态描述最详尽的是
A. B.1s22s22p2 C.
B.1s22s22p2 C. D.
D.
-
月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
A.He比H多一个中子 B.氦元素的近似相对原子质量为3
C.He的相对原子质量为 D.He的摩尔质量为bNA
D.He的摩尔质量为bNA
-
下列有机物命名正确的是
A. α- 氨基乙酸
α- 氨基乙酸
B. 2-二氯丙烷
2-二氯丙烷
C. 2-甲基丙醇
2-甲基丙醇
D.C17H33COOH硬脂酸
-
奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击发声的同时产生白色烟雾,反应的化学方程式为:5KC1O3+6P→3P2O5+5KC1。下列有关该反应的叙述中正确的是
A.P2O5是还原产物
B.发令时产生的白烟一定是KC1固体颗粒
C.可以用白磷代替“火药”中的红磷
D.反应消耗1mol P时转移的电子数为5mol
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
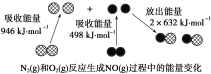
A.1 mol N2(g)和NA个 O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
-
如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是
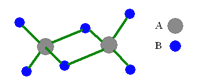
A.该化合物的化学式是Al2Cl6
B.该化合物在固态时所形成的晶体是分子晶体
C.该化合物是离子化合物,在熔融状态下能导电
D.该化合物中存在共价键,且不含有非极性共价键
-
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2-② K+、Fe2+、I-、SO42-③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
-
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-)=c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C.若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D.若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
-
中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”, 煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。其结构简式如图所示:下列说法不正确的是
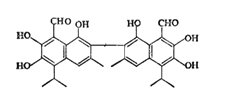
A.该化合物的分子式为:C30H30O8
B.1mol棉酚最多可与10mol H2加成,与6molNaOH反应
C.在一定条件下,可与乙酸反应生成酯类物质
D.该物质可以使酸性高锰酸钾溶液褪色
-
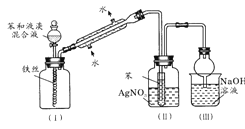
某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流计A指针偏转。下列有关描述正确的是
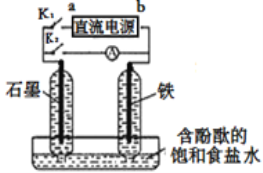
A.断开K2,闭合K1时,总反应的离子方程式为:2Cl-+2H+  H2↑+Cl2↑
H2↑+Cl2↑
B.断开K2,闭合K1时,a是电源的正极,铁电极发生氧化反应
C.断开K1,闭合K2时,石墨电极附近溶液变红,铁电极上的电极反应为:Cl2+2e—=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
-
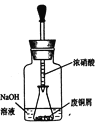
为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是
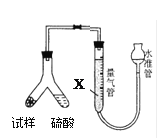
A.可用稀盐酸代替稀硫酸
B.量气管中液体为水
C.反应完全后,冷却,读取量气管体积数,再减去所加硫酸的体积,即为生成的气体体积
D.实验测得该试样中碳酸氢钠质量分数偏高,可能是测定气体体积时未冷却至室温
-
下列化学工业有关设备、原料、反应条件配套的是
A.联合制碱法制纯碱:吸氨塔、碳酸塔,食盐、二氧化碳、氨,30℃-35℃的氨化饱和食盐水吸收CO2
B.接触法制硫酸:氧化炉,硫铁矿、V2O5,4000-5000 ℃
C.合成氨:沸腾炉,焦炭、铁触媒,5000℃
D.氨氧化法制硝酸:合成塔,空气、铂铑合金,8000℃
-
铜和镁的合金2.3 g完全溶于浓HNO3,若反应中硝酸被还原只产生2.240 L的NO2气体和168 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生产沉淀的质量为
A.4.1275 g B.4.255 g C.8.51 g D.9.62 g
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:NH4+、Cl-、Mg2+、Ba2+、K+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是
A.K+可能存在 B.该溶液中含CO32-离子的浓度为0.2mol/L
C.Cl-一定不存在 D.Ba2+一定不存在,Mg2+可能存在
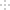 ,则原混合气体的平均相对分子质量不可能是
,则原混合气体的平均相对分子质量不可能是




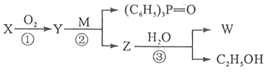
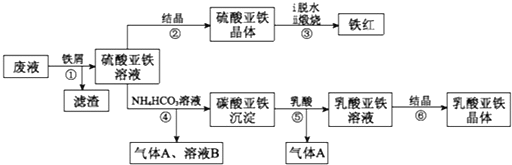

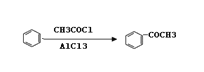 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、