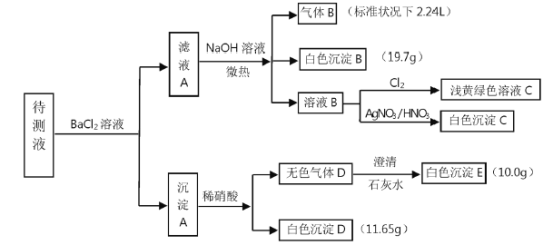
-
苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变化为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
A.氧化性 B.还原性 C.碱性 D.酸性
难度: 中等查看答案及解析
-
在含有Fe3+、Fe2+、Al3+、Na+的溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,溶液中离子数目几乎没有变化的是( )
A.Fe3+ B.Fe2+ C.Al3+ D.Na+
难度: 中等查看答案及解析
-
运城市被中央文明办确定为2018-2020年创建周期全国文明城市提名城市。目前发布的“城市空气质量周报”,下列物质中不被列入污染物的是
A.二氧化硫 B.二氧化碳 C.PM2.5与可吸入颗粒物 D.二氧化氮
难度: 中等查看答案及解析
-
下列气体不能用排水法收集的是
A.O2 B.H2 C.NH3 D.NO
难度: 中等查看答案及解析
-
屠呦呦是我国第一位诺贝尔医学奖获得者,她从青蒿中提取青蒿素的过程中,多次采用萃取操作。该操作中涉及的主要仪器是
A.
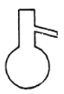 B.
B.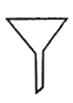 C.
C.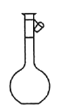 D.
D.
难度: 中等查看答案及解析
-
对下列分类依据和结论都正确的是
A.明矾、芒硝都是盐,都属于纯净物
B.HNO3、C2H5OH都易溶于水,都是电解质
C.苏打、氢氧化钠溶液均显碱性,都是碱
D.H2SO4、H2SiO3分子中均含有两个氢原子,都是二元强酸
难度: 中等查看答案及解析
-
化学知识与生产、生活密切相关。下列说法错误的是
A.SiO2是将太阳能转变为电能的常用材料 B.Al(OH)3胶体具有吸附性,可用作净水剂
C.硫酸钡可用于胃肠X射线造影检查 D.铝合金大量用于高铁建设
难度: 中等查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A.硝酸铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+↑+2H2O
B.用铝粉和NaOH溶液反应制取大量H2:Al+2OH-=AlO2-+H2↑
C.实验室制取Cl2:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
D.氯气溶于水,与水的反应:Cl2+H2O=2H++Cl-+ClO-
难度: 中等查看答案及解析
-
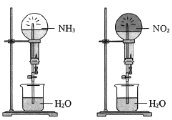
下列有关实验原理或操作正确的是
A.喷泉实验

B.实验室制备并收集二氧化碳
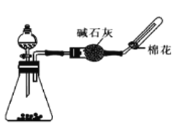
C.收集NO
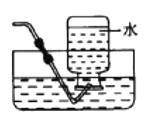
D.干燥氯气

难度: 中等查看答案及解析
-
下列各组物质其X中混有少量杂质Y,用Z进行除杂,其中所加试剂最合理的一组是
选项
X
Y
Z
A
Al2O3固体
Fe2O3
硫酸溶液
B
CO2
HCl
饱和碳酸氢钠溶液
C
氯化钾溶液
MgCl2
过量的氢氧化钠溶液
D
Cl2
HCl
氢氧化钠溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值。下列说法正确的是
A.1 L0.5 mol/L Na2SO3溶液中含氧原子数为1.5NA
B.1 mol Na2O2中阴阳离子总数为3NA
C.4.6 g NO2和N2O4混合气体中含氧原子数为0.3NA
D.11.2 L NH3所含的分子数为0.5NA
难度: 中等查看答案及解析
-
粗盐中含Ca2+、Mg2+、Fe2+、SO42-等杂质,需要提纯后才能综合利用。提纯过程中的操作步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加盐酸调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发
欲除去上述离子,则正确的操作顺序是
A.⑤②③①⑥④⑦ B.⑤①②③⑥④⑦
C.⑤②①③④⑥⑦ D.⑤③①②⑥④⑦
难度: 中等查看答案及解析
-
某学生以铁丝和Cl2为原料,进行如图三个实验。下列说法不正确的是
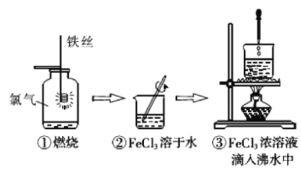
A.实验①所涉及的物质均为电解质 B.实验②未发生氧化还原反应
C.实验③可以制得Fe(OH)3胶体 D.实验③发生的反应为复分解反应
难度: 中等查看答案及解析
-
向含有NaOH的NaAlO2溶液中逐滴滴入稀H2SO4,图中能正确表示反应产生沉淀的物质的量与加入硫酸体积的正确关系是
A.
 B.
B.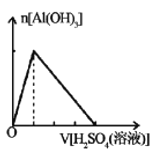
C.
 D.
D.
难度: 中等查看答案及解析
-
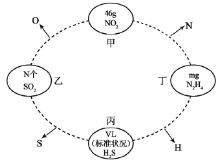
硫酸铁和硫酸亚铁固体的混合物,若其中铁元素的质量分数为a%,则其中硫元素的质量分数为
A.(100-3a)% B.
C.
D.
难度: 中等查看答案及解析
-
向500 mL稀硝酸中加入一定量的铁粉,铁粉完全溶解后,放出NO 6.272L(标准状况下),同时溶液质量增加11.2g。下列判断不正确的是
A.原HNO3溶液的物质的量浓度为2.24 mol·L-1
B.原溶液中投入铁粉的物质的量是0.2 mol
C.反应后溶液中c(Fe3+):c(Fe2+)=2:3
D.反应后的溶液还可以溶解铜粉4.48g
难度: 中等查看答案及解析