-
下列实验操作与结论都正确且有相关性的是( )
选项
实验操作及现象
结论
A
向酸性高锰酸钾溶液中滴加适量乙醛溶液,充分振荡,紫红色褪色
乙醛具有还原性
B
向某溶液中滴加Ba(NO3)3溶液和盐酸,产生白色沉淀
该溶液含SO42-
C
向品红溶液中通入气体R,溶液变无色;微热,颜色无变化
R一定是Cl2
D
将丁烷的裂解气通入溴水中,溴水褪色
裂解气一定含乙烯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学与生活、环境密切相关,下列说法错误的是( )
A.享有“镇国之宝”称谓的“司母戊鼎”属于青铜制品
B.“煤改气”可以减少SO2等有害物质的排放量,有利于“雾霾”天气的治理
C.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D.做油条用的膨松剂不应含明矾
难度: 简单查看答案及解析
-
乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:
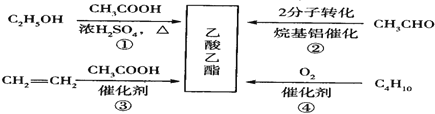
下列说法正确的是( )
A.反应①、②均是取代反应
B.反应③、④的原子利用率均为100%
C.与乙酸乙酯互为同分异构体的酯类化合物有2种
D.乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A.3.2gO2与钠完全反应后,生成的阴离子的总数为0.2NA
B.0.1mol氯气完全溶于水后,溶液中Cl-、HClO数目之和为0.2NA
C.1.7g氨气与2.24L氨气中氨分子数目均为0.1NA
D.0.1mol 甘油(C3H8O3)与丙醇的混合物完全燃烧生成的水分子数目为0.4NA
难度: 中等查看答案及解析
-
我国成功研制出一种全新的铝-石墨双离子电池(AGDIB),这种新型AGDIB电池采用廉价且易得的石墨、铝箔作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。该电池工作原理是:充电过程中,石墨发生阴离子插层反应,而铝电极发生铝-锂合金化反应,放电过程则相反。电池反应式为CxPF6+ LiyAl
Cx+LiPF6+ Liy-1Al,下列说法不正确的是
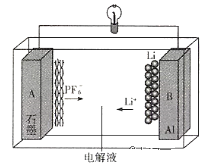
A.铝箔是电池负极
B.充电时,铝电极发生铝—锂合金化反应是还原反应
C.充电时A作阳极,放电时A电极的电极反应式为CxPF6+e-=Cx+
D.废旧AGDIB电池进行“放电处理”,让Li+进入石墨中而有利于回收
难度: 中等查看答案及解析
-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W的最外层电子数与X、Y的最外层电子数之和相等,X在周期表中所处的周期数等于族序数,在周期表前四周期的所有主族元素中Z的原子序数最大。下列说法正确的是( )
A.原子半径:Y>X>W
B.W、Z的最高正价之和等于8
C.W、X的简单离子的电子层结构相同
D.X的最高价氧化物对应水化物的碱性比Z强
难度: 中等查看答案及解析
-
四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
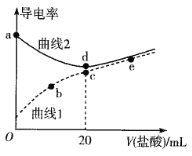
下列说法正确的是
A.曲线1代表四甲基氢氧化铵溶液
B.在b、c、e三点中,水的电离程度最大的点是e
C.b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D.常温下,CH3NH3Cl水解常数的数量级为10-11
难度: 困难查看答案及解析
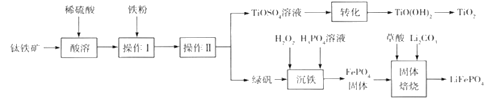
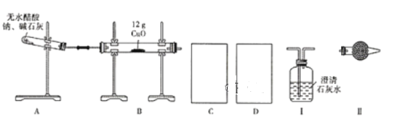
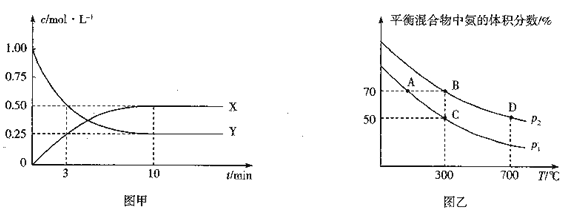
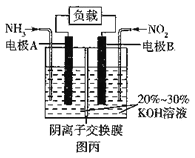
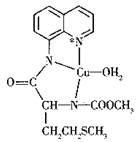
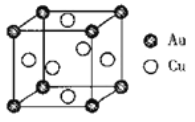
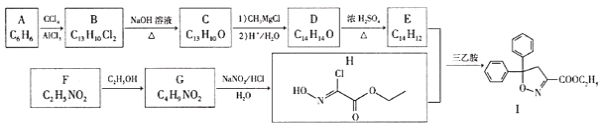
 (不稳定)
(不稳定)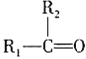
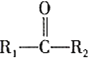
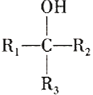 ;RCl
;RCl