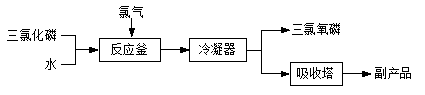
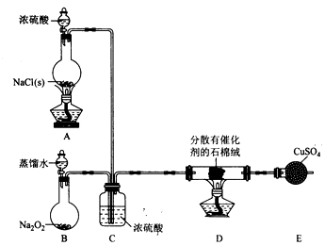
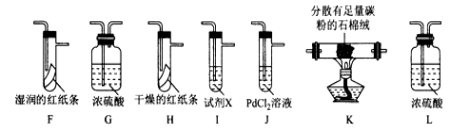
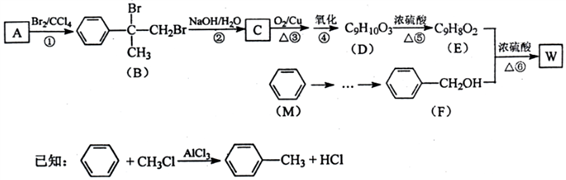
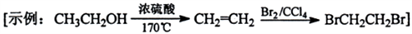-
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对从地表渗出的、当地人称为“石脂”或“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松果不及也,此物必大行于世”的描述, 关于上文的下列说法中正确的是 ( )
A.“洧水”的主要成分是油脂 B.“洧水”的主要成分是煤油
C.“洧水”的主要成分是石油 D.其烟的主要成分是石墨
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 1mol·L-1AlCl3溶液中,含Al3+数目小于NA
B. 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA
C. 25℃,1LpH=1的稀硫酸中含有的H+数为0.2NA
D. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COOˉ数目为NA个
难度: 简单查看答案及解析
-
三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是( )
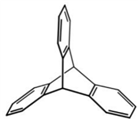
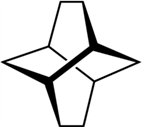
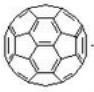
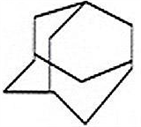
①(三碟烯) ②(扭曲烷) ③(富勒烯) ④(金刚烷)
A. ①③均能发生加成反应 B. ①④互为同分异构体
C. ①②③④均属于烃 D. ①②③④的一氯代物均只有一种
难度: 中等查看答案及解析
-
短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃,0.01mol·Lˉ1w溶液中,
。上述物质的转化关系如图所示。下列说法正确的是( )
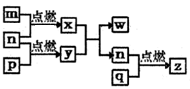
A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:
D. y、w含有的化学键类型完全相同
难度: 困难查看答案及解析
-
如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B. 当A接电源的正极时,此时Li+脱离离子存储层
C. 当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
难度: 中等查看答案及解析
-
下列设计的实验方案能达到相应实验目的是( )
选项
实验目的
实验方案
A
蛋白质发生了变性
向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液
B
证明反应速率会随反应物浓度的增大而加快
用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·Lˉ1CuSO4溶液,迅速产生较多气泡
C
比较Ksp(BaCO3)、Ksp(BaSO4)
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
D
通过观察液面差判断该装置的气密性
 向里推注射器
向里推注射器A. A B. B C. C D. D
难度: 简单查看答案及解析
-
一定条件下,某含碳钢腐蚀情况与溶液pH的关系如表
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2﹣
下列说法正确的是( )
A. 随pH的升高,碳钢腐蚀速率逐渐加快
B. pH<4,发生析氢腐蚀
C. pH为14,其负极反应为2H2O+Fe_3e﹣═FeO2﹣+4H+
D. 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会加快
难度: 中等查看答案及解析