-
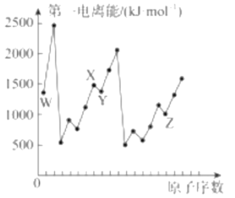
W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W元素的一种核素可用于鉴定文物年代,X元素的一种单质可作为饮用水消毒剂,Y元素的简单离子是同周期元素的简单离子中半径最小的,Z元素和W元素同主族,R元素被称为“成盐元素”。下列说法错误的是
A. W元素和X元素形成的化合物WX2属于非极性分子
B. 工业上常用电解熔融Y元素和R元素形成的化合物的方法来制取单质Y
C. 制造日常生活中所使用的计算机芯片需要消耗大量单质Z
D. X元素和R元素形成的某种化合物可用于自来水的消毒
难度: 困难查看答案及解析
-
中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键说法中不正确的是( )
A. 由于氢键的存在,冰能浮在水面上
B. 由于氢键的存在,乙醇比甲醚更易溶于水
C. 由于氢键的存在,沸点:HF>HCl>HBr>HI
D. 由于氢键的存在,影响了蛋白质分子独特的结构
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B. 水很稳定是因为水中含有大量的氢键所致
C. H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3 杂化
D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
难度: 中等查看答案及解析
-
科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是[Ne]3s23p6。下列说法正确的是( )
A. 两粒子都达8电子稳定结构,化学性质相同
B. 两粒子的电子发生跃迁时,产生的光谱不同
C. 两粒子的1s能级上电子的能量相同
D. 两粒子的3p能级上的电子离核的距离相同
难度: 困难查看答案及解析
-
下列说法不正确的是
A. 某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X2+
B. 氨气极易溶于水的重要原因之一:氨分子与水分子之间能形成氢键
C. 标况下,22.4LC2H2中所含的π键数和18g冰中所含的氢键数均为2NA
D. 由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3
难度: 困难查看答案及解析
-
分子里碳原子数不超过10的所有烷烃中,一卤代物只有一种的烷烃共有( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是1s22s22p63s23p63d44s2
难度: 中等查看答案及解析
-
下列每组物质发生变化所克服的粒子间的作用力属于同种类型的是( )
A.氯化铵受热气化和苯的气化
B.碘和干冰受热升华
C.二氧化硅和生石灰的熔化
D.氯化钠和铁的熔化
难度: 中等查看答案及解析
-
根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的立体构型正确的是( )
选项
分子式
中心原子
杂化方式
价层电子对
互斥模型
分子或离子
的立体构型
A
SO2
sp
直线形
直线形
B
HCHO
sp2
平面三角形
三角锥形
C
NF3
sp2
四面体形
平面三角形
D
NH4+
sp3
正四面体形
正四面体形
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有机物数目非常庞大,是由多种原因造成的,下列说法不确切的是( )
A.碳原子间可形成单键、双键、三键
B.碳链上碳原子可以与多种原子(或原子团)形成共价键
C.碳链化合物都非常稳定
D.碳链化合物能形成各种同分异构体
难度: 中等查看答案及解析
-
根据中学化学教材所附元素周期表判断,下列叙述中正确的是
A. L电子层电子数为奇数的所有元素都是非金属
B. 同一主族的两种元素的原子序数之差可能是16、26、36、46
C. 只有第IIA族元素的原子最外层有2个电子
D. 由左至右第8、9、10 三列元素中没有非金属元素
难度: 中等查看答案及解析
-
X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2s2,Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是
A.EYQ4 中阴离子中心原子的杂化方式为sp3杂化
B.X、Y元素的第一电离能大小关系:X<Y
C.ZO32-的空间构型为V形
D.MZ2仅含离子键,可用于制备乙炔
难度: 困难查看答案及解析
-
具有如下电子层结构的原子,其相应元素一定属于同一族的是
A. 3p能级上有2个未成对电子的原子和4p能级上有2个未成对电子的原子
B. 3p能级上只有1个空轨道的原子和4p能级上只有1个空轨道的原子
C. 最外层电子排布式为ns2的原子和最外层电子排布式为(n+1)s2的原子
D. 最外层电子排布式为ns2的原子和最外层电子排布式为(n+1)s2(n+1)p6的原子
难度: 中等查看答案及解析
-
前四周期元素
、
、
、
、
的原子序数依次增大。
与
同周期且相邻的非金属元素,
的基态原子的s电子数与p电子数相等,
是地壳中含量最多的金属元素,
的原子核外价电子排布式为
,
的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是
A.简单气态氢化物的稳定性:
B.简单离子的半径:
C.
的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由
、
、
三种元素形成的某种化合物可用于检查司机是否酒后驾车
难度: 中等查看答案及解析
-
原子核外p能级、d能级等原子轨道上电子排布为“全空”“半满”“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实不能作为这个规则的证据的是( )
A.硼元素的第一电离能小于铍元素的第一电离能
B.磷元素的第一电离能大于硫元素的第一电离能
C.基态铜原子的核外电子排布式为
而不是
D.某种激发态碳原子的核外电子排布式为
而不是
难度: 中等查看答案及解析
-
铬(Cr)的最高正价为+6价,由此可以推断CrO5的结构是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为
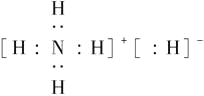
D.它与水反应的化学方程式为NH5+H2O=NH3·H2O+H2↑
难度: 中等查看答案及解析
-
下列有关微粒间作用力的说法正确的是
A. 硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中B原子发生的是sp3杂化,不同层分子间主要作用力是范德华力
B. 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似也有方向性和饱和性
C. 干冰气化和冰融化克服的分子间作用力相同
D. 离子晶体熔融状态电离过程中,只有离子键被破坏
难度: 中等查看答案及解析
-
下列晶体中,①冰 ②石英 ③足球烯(C60) ④食盐 ⑤白磷 ⑥冰醋酸 ⑦晶体氩。晶体中除了存在原子与原子间的共价键外,同时也存在范德华力的有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
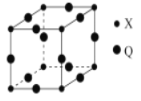
图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中Q为+3价,G为-2价,则R的化合价为

A.+1 B.+2 C.+3 D.+4
难度: 中等查看答案及解析
-
下列物质的类别与所含官能团都正确的是( )
A.
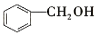 酚类 –OH B. CH3-O-CH3 醚类
酚类 –OH B. CH3-O-CH3 醚类 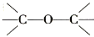
C.
 醛类 –CHO D.
醛类 –CHO D.  羧酸类 -CHO
羧酸类 -CHO难度: 中等查看答案及解析
-
下列有机物按碳的骨架进行分类,其中与其他三种有机物属于不同类别的是
A.
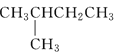 B.CH2=CH2 C.
B.CH2=CH2 C.D.CH3C≡CH
难度: 中等查看答案及解析
-
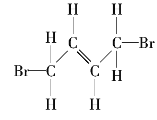
下列关于
 的说法正确的是( )
的说法正确的是( )A.最多只有4个C原子共平面
B.除苯环外的C原子共直线
C.所有C原子可能共平面
D.最多只有3个C原子共直线
难度: 中等查看答案及解析
-
对如图有机物的叙述,正确的是( )
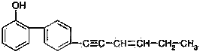
A. 该有机物的分子式为C18H15O
B. 该有机物中共线的碳原子最多有7个
C. 该有机物中共面的碳原子最多有17个
D. 该有机物在常温下易溶于水
难度: 中等查看答案及解析
-
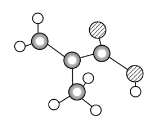
利用碳原子的成键特点,分子式为C4H6的物质说法错误的是 ( )
A.分子中含有环和一个碳碳双键 B.分子中含有二个碳碳双键
C.分子中含有一个碳碳叁键 D.分子中含有环和碳碳叁键
难度: 中等查看答案及解析
-
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是
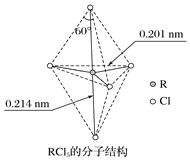
A.R原子不满足8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°两种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.分子中5个R—Cl键键能不都相同
难度: 简单查看答案及解析
-
Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol该配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=4,n=5
难度: 困难查看答案及解析
-
高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )
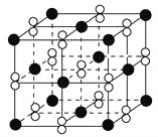
A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
难度: 困难查看答案及解析
-
经X射线研究证明PCl5在固态时,其空间构型分别是正四面体和正八面体的两种离子构成,下列关于PCl5的推断正确的是( )
A.PCl5晶体是分子晶体
B.PCl5晶体由[PCl3]2+和[PCl2]2-构成,且离子数目之比为1∶1
C.PCl5晶体由[PCl4]+和[PCl6]-构成,且离子数目之比为1∶1
D.PCl5晶体具有良好的导电性
难度: 困难查看答案及解析
-
下列各图是从晶体结构图中分割出来的部分结构图(图中白球表示阳离子,黑球表示阴离子),其中属于从NaCl晶体中分割出来的结构图是
A.
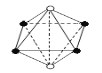 B.
B. C.
C.D.
难度: 困难查看答案及解析