-
实现中国梦,离不开化学与科技的发展。下列说法不正确的是
A.2019年新冠肺炎“疫苗”等生物制剂需要冷冻保存
B.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
C.纳米复合材料实现了水中微污染物铅(Ⅱ)的高灵敏、高选择性检测,但吸附的量小
D.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
难度: 简单查看答案及解析
-
阿伏加德罗常数用NA表示,下列叙述正确的是
A.18克液态水与18克冰中氢键数目均为NA
B.工业酸性废水中的Cr2O72-可转化为Cr3+除出,现用电解的方法模拟该过程,阴极为石墨,阳极为铁,理论上电路中每通过6mol电子,就有NA个Cr2O72-被还原
C.标准状况下,22.4LNO2含有的原子数小于3NA
D.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA
难度: 中等查看答案及解析
-
因新型冠状病毒肺炎疫情防控需求,口罩已经成为了2020每个人必备之品。熔喷布,俗称口罩的“心脏”,是口罩中间的过滤层,能过滤细菌,阻止病菌传播。熔喷布是一种以高熔融指数的聚丙烯(PP)为材料,由许多纵横交错的纤维以随机方向层叠而成的膜。其中有关聚丙烯的认识正确的是
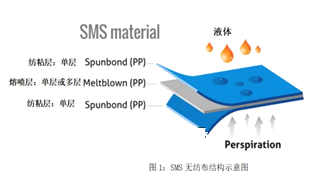
A.由丙烯通过加聚反应合成聚丙烯
B.聚丙烯的链节:—CH2—CH2—CH2—
C.合成聚丙烯单体丙烯的结构简式:CH2CHCH3
D.聚丙烯能使溴水发生加成反应而褪色
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W是地壳中含量最高的元素,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是
A.Y单质的熔点高于X单质 B.W、Z的氢化物沸点W>Z
C.X、W、Z能形成具有强还原性的XZW D.X2YW3中含有共价键
难度: 中等查看答案及解析
-
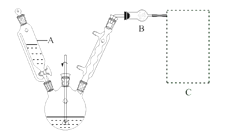
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,下列说法不正确的是
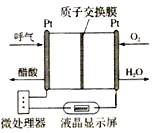
A.该电池的负极反应式为:CH3CH2OH + 3H2O - 12e-
2CO2↑ + 12H+
B.该电池的正极反应式为:O2 + 4e- + 4H+
2H2O
C.电流由O2所在的铂电极经外电路流向另一电极
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
难度: 中等查看答案及解析
-
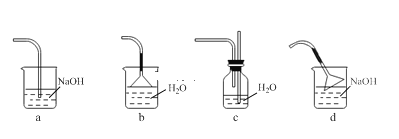
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
实验目的
实验方案
所选玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
证明CH3COOH与HClO的酸性强弱
相同温度下用pH试纸测定浓度均为0.1 mol·L-1NaClO、CH3COONa溶液的pH
玻璃棒、玻璃片
C
配制1 L 1.6%的CuSO4溶液(溶液密度近似为1 g·mL-1)
将25 g CuSO4·5H2O溶解在975 g水中
烧杯、量筒、玻璃棒
D
检验蔗糖水解产物具有还原性
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
试管、烧杯、酒精灯、滴管
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
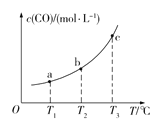
己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是
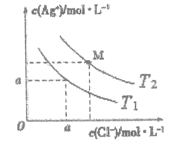
A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
难度: 中等查看答案及解析
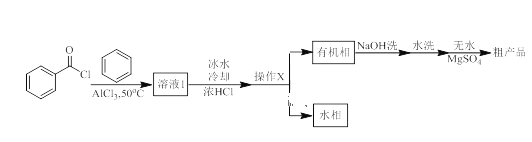
 。该反应剧烈放热。
。该反应剧烈放热。