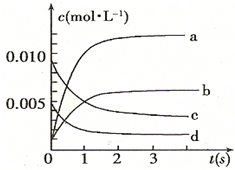
-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O⇌HCOO-+H3O+
B.CO2+H2O⇌HCO3-+H+
C.CO32-+H2O⇌HCO3-+OH-
D.HS-+H2O⇌S2-+H3O+难度: 中等查看答案及解析
-
化学与生活、社会密切相关.下列说法错误的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染难度: 中等查看答案及解析
-
为达到预期的实验目的,下列操作正确的是( )
A.欲配制质量分数为10%的ZnS04溶液,将10gZnS04•7H20溶解在90g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用难度: 中等查看答案及解析
-
酸碱完全中和时( )
A.酸和碱的物质的量一定相等
B.酸所提供的H+与碱提供的OH-的物质的量相等
C.酸和碱的物质的量浓度相等
D.溶液一定呈中性难度: 中等查看答案及解析
-
已知在25℃,101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.
B.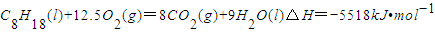
C.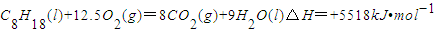
D.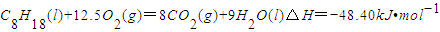
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)KJ/mol
B.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2 (g)=2CO(g)+O2 (g)反应的△H=+2×283.0kJ/mol难度: 中等查看答案及解析
-
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g),△H=-1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
醋酸溶液中存在电离平衡:CH3 COOH→H++CH3 COO-,下列叙述不正确的是( )
A.CH3 COOH 溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3 COO-)
B.0.1 mol•L-1的CH3 COOH 溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH 溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH 溶液与pH=12的NaOH 溶液等体积混合后,溶液的pH<7难度: 中等查看答案及解析
-
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol•L-1,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液.
A.①④
B.①②
C.②③
D.③④难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因电化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动难度: 中等查看答案及解析
-
用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)难度: 中等查看答案及解析
-
如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色.下列说法中正确的是( )

A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的浓度逐渐减小
D.CuSO4溶液的pH减小难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7难度: 中等查看答案及解析
-
准确量取25.00毫升高锰酸钾溶液,可选用的仪器是( )
A.50 mL量筒
B.25 mL量筒
C.50 mL碱式滴定管
D.50 mL酸式滴定管难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是(提示BaSO4(s)⇌Ba2+(aq)+SO42-(aq)的平衡常数Ksp=[Ba2+]•[SO42-],称为溶度积常数)( )
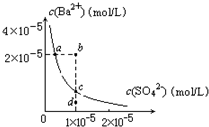
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH)
D.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)难度: 中等查看答案及解析