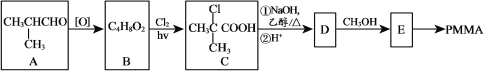-
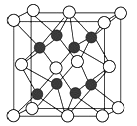
下列各物质的晶体中,晶体类型相同的是
A.O2和SiO2 B.NaI和I2 C.CO2和H2O D.CCl4和NaCl
难度: 简单查看答案及解析
-
下列物质在生活中应用时,起还原作用的是( )
A.明矾作净水剂 B.甘油作护肤保湿剂
C.漂粉精作消毒剂 D.铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
已知 2Na + 2H2O = 2NaOH + H2↑,该反应中相关物质的化学用语中正确的是
A.H2 的结构式:H-H
B.中子数为 12 的钠原子:
C.H2O 的电子式:
D.Na+的结构示意图:
难度: 简单查看答案及解析
-
用 NA 表示阿伏加德罗常数的值,下列说法正确的是
A.22.4 L CH4 中含有共价键数为 4 NA
B.1 mol -OH 中含有电子数为 9 NA
C.1 L 1 mol·L-1FeCl3 溶液中含有 Fe3+数为NA
D.常温常压下,32 g O2 中含有氧分子数为 2 NA
难度: 中等查看答案及解析
-
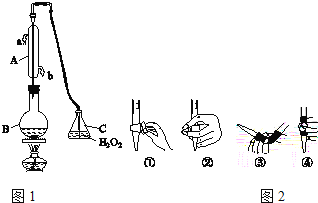
下列实验装置正确且能达到实验目的的是
A
B
C
D
实验目的
实验室制乙酸乙酯
比较碳酸与苯酚酸性强弱
加入CCl4分离碘水中的碘
蒸干FeCl3溶液制无水FeCl3
实验装置

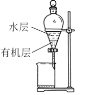

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列解释事实的离子方程式不正确的是( )
A.用石墨电极电解饱和食盐水:2Cl- + 2H2O
2OH-+ H2↑+ Cl2↑
B.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+CO32-
CaCO3(s) + SO42-
C.过量铁粉与稀硝酸反应:Fe+NO3-+4H+= Fe3++NO↑+2H2O
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++OH-+H++SO42-= BaSO4↓+H2O
难度: 中等查看答案及解析
-
工业制备硝酸的反应之一为:3NO2 + H2O=2HNO3+NO。用 NA 表示阿伏加德罗常数, 下列说法正确的是
A.室温下,22.4 L NO2 中所含原子总数为 3NA
B.36gH2O 中含有共价键的总数为 2NA
C.标准状况下,11.2L NO 中所含电子总数为 5NA
D.上述反应,生成 1molHNO3 转移电子的数目为NA
难度: 中等查看答案及解析
-
根据有关操作与现象,所得结论不正确的是
选项
操作
现象
结论
A
向FeCl3溶液中滴加KI、淀粉溶液
溶液变蓝
I-有还原性
B
向某溶液中滴加AgNO3溶液
产生白色沉淀
溶液一定含有Cl-
C
酸性KMnO4溶液与H2C2O4溶液反应,加入MnSO4溶液
紫色褪去速率加快
Mn2+对该反应有催化作用
D
向酸性KMnO4溶液中滴加FeSO4溶液
紫色褪去
Fe2+有还原性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2019年为“国际化学元素周期表年”。如图所示是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
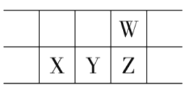
A.原子半径:W<X
B.气态氢化物热稳定性:Z<W
C.Y单质可用做半导体材料
D.X的最高价氧化物的水化物是强碱
难度: 中等查看答案及解析
-
下列说法中正确的是
A.2p2 表示 2p 能级有两个轨道
B.处于最低能量的原子叫做基态原子
C.同一原子中, 2s、3s 电子的能量逐渐减小
D.同一原子中,2p、3p、4p 能级的轨道数依次增多
难度: 中等查看答案及解析
-
下列说法中正确的是
A.非极性分子只能是双原子单质分子
B.键能越大,表示该分子越容易受热分解
C.液态氟化氢中氟化氢分子之间存在氢键
D.分子中中心原子通过 sp3 杂化轨道成键时,该分子一定为正四面体结构
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.若 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,则 H2 燃烧热为 241.8 kJ/mol
B.若 C(石墨,s) =C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4kJ/mol,则 20.0 g NaOH固体与稀盐酸完全中和,放出 28.7 kJ 的热量,
D.已知 2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则 ΔH1>ΔH2
难度: 中等查看答案及解析
-
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)=2H2O(g) ΔH2
C(s)+O2(g)=CO2(g) ΔH3
则反应 4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的 ΔH 为
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
难度: 中等查看答案及解析
-
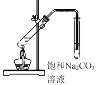
如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。 下列说法正确的是

A.a 处得到的是浓 NaOH 溶液
B.适当降低阳极电解液的 pH 有利于 Cl2 逸出
C.粗盐水中含有的少量 Ca2+和 Mg2+可用 NaOH 除去
D.若电路中通过 0.2mol 电子,理论上可在 b 处得到标准状况下 1.12L 气体
难度: 中等查看答案及解析
-
关于下列装置的说法正确的是

A.装置①将电能转变为化学能
B.装置①中盐桥内的 K+移向 CuSO4 溶液
C.若装置②用于铁棒镀铜,则 N 极为铁棒
D.若装置②用于电解精炼铜,溶液中的 Cu2+浓度保持不变
难度: 中等查看答案及解析
-
阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是( )
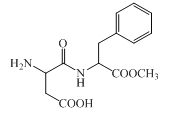
A.分子式为C14H18N2O5
B.不存在顺反异构
C.能发生取代和消去反应
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
某温度下,恒容密闭容器内发生反应:H2(g)+I2 (g)
HI(g) Δ H< 0,该温度下, K=43。某时刻,测得容器内 H2、I2、HI 的浓度依次为 0.01 mol/L、0.01mol/L、0.02mol/L。 一段时间后,下列情况与事实相符的是
A.氢气的体积分数变小 B.混合气体密度变大
C.混合气体颜色变深 D.容器内压强变小
难度: 中等查看答案及解析
-
下列说法正确的是
A.同一反应,加入催化剂,改变了反应的途径,反应的 ΔH 也随之改变
B.SO2 的催化氧化是一个放热反应,所以升高温度,反应速率减慢
C.化学平衡发生移动,平衡常数不一定发生变化
D.反应 2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的 ΔH>0
难度: 中等查看答案及解析
-
下列说法错误的是
A.酸式盐溶液不一定呈酸性
B.离子能够发生水解的盐溶液可能呈中性
C.同温度下,同浓度的 Na2CO3 和 NaHCO3 溶液相比后者 pH 小
D.溶度积常数 Ksp 只受温度影响,温度升高 Ksp 增大
难度: 中等查看答案及解析
-
25℃时,下列关于 pH=3 的 CH3COOH 溶液的叙述正确的是
A.溶液中 H2O 电离出的 c(OH−)=1.0×10−3 mol·L−1
B.加0.1 mol·L−1CH3COONa 溶液使 pH>7,则 c(CH3COO−)=c(Na+)
C.加入少量 CH3COONa 固体后,溶液 pH 升高
D.与等体积 pH=11 的 NaOH 溶液混合,所得溶液呈中性
难度: 中等查看答案及解析