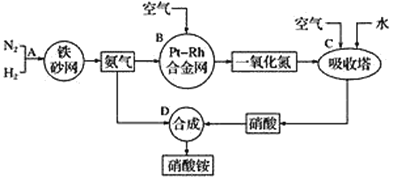
-
下列各组元素性质或原子结构递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数依次增多
难度: 简单查看答案及解析
-
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法
现象
结论
A
观察氯水颜色
氯水呈黄绿色
氯水中含Cl2
B
向饱和NaHCO3溶液中加入足量氯水
有无色气体产生
氯水中含HClO
C
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
D
向浅绿色的FeCl2溶液中滴加氯水
溶液变成棕黄色
氯水具有氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
浓硫酸与下列物质作用时,既表现氧化性,又表现酸性的是( )
①红热的木炭 ②H2S气体 ③Cu ④FeO ⑤NH3 ⑥使木材炭化 ⑦CuSO4·5H2O ⑧对铁、铝的钝化
A.③④ B.①②⑤⑧ C.①②③④⑦ D.以上答案均不正确
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A.H、D、T具有相同的质子数,是氢元素的三种核素
B.OH-与H3O+组成元素相同,所含质子数相同
C.13C与15N有相同的中子数
D.15N的核外电子数与核内中子数相等
难度: 简单查看答案及解析
-
下列有关硅及其化合物的叙述错误的是( )
A.水晶、玛瑙、电子芯片等主要成分都是SiO2
B.水玻璃是制备硅胶和木材防火剂的原料
C.硅酸盐Na2Fe2Si3O10用氧化物的形式可表示为:Na2O•Fe2O3•3SiO2
D.水泥、玻璃、陶瓷是三大传统硅酸盐产品,都是混合物
难度: 简单查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
难度: 简单查看答案及解析
-
地震后,抗震救灾要用大量漂白粉和漂白液杀菌消毒。下列叙述中正确的是( )
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水中制取漂白粉
D. 漂白液的有效成分是Na2O2
难度: 简单查看答案及解析
-
下列实验操作中,始终无明显变化的是( )
A.NO2通入FeSO4溶液中
B.SO2通入已酸化的Ba(NO3)2溶液中
C.Cl2通入NaBr溶液中
D.CO2通入CaCl2溶液中
难度: 简单查看答案及解析
-
对3NO2+H2O=2HNO3+NO反应的下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.氧化产物与还原产物的物质的量之比为1∶2
C.氧化剂与还原剂的质量比为1∶2
D.在反应中若有6molNO2参与反应时,有3mol电子发生转移
难度: 简单查看答案及解析
-
下列反应中,调节反应物用量或浓度,不会改变反应产物的是( )
A.铁在硫蒸气中燃烧
B.HNO3与Cu反应
C.二氧化硫通入澄清石灰水
D.硫酸中加入锌粉
难度: 简单查看答案及解析
-
如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
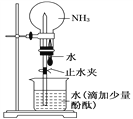
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
难度: 简单查看答案及解析
-
元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是
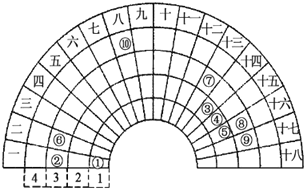
A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
原子半径/nm
0.186
0.102
0.075
0.074
0.143
主要化合价
+1
+6、-2
+5、-3
-2
+3
已知X是短周期中最活泼的金属,且与R同周期。下列叙述不正确的是( )
A.离子半径大小:R3+<X+<M2-
B.Y与M组成的化合物是形成酸雨的原因之一
C.将YM2通入酸性高锰酸钾溶液中,溶液褪色,说明YM2具有漂白性
D.M的氢化物和Z的氢化物都有分子间氢键
难度: 中等查看答案及解析
-
(CN)2、(OCN)2、(SCN)2等化合物的性质与卤素单质相似,称为“类卤素”。已知卤素单质和“类卤素”的氧化性由强到弱的顺序为:F2、(OCN)2、Cl2、Br2、(CN)2、(SCN)2、I2。下列叙述正确的是( )
A.反应I22SCN-2I-(SCN)2能自发进行
B.反应Cl22CN-2Cl-(CN)2不能自发进行
C.还原性:F-OCN-Br-SCN-
D.“类卤素”在碱性溶液中不能发生自身的氧化还原反应
难度: 简单查看答案及解析
-
高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
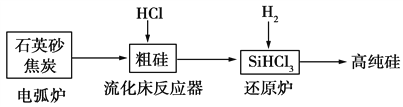
下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
难度: 中等查看答案及解析
-
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
难度: 中等查看答案及解析
-
下列分析中正确的是( )
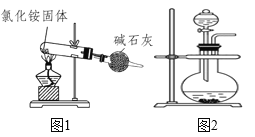
A.如图1装置能制得纯净的氨气
B.如图1中的氯化铵可用硝酸铵替代制备氨气
C.如图2可用浓氨水和氢氧化钠固体来制备氨气
D.如图1中碱石灰可用CaCl2替代来干燥氨气
难度: 简单查看答案及解析
-
用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
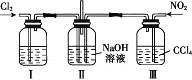
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
难度: 中等查看答案及解析
-
含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析