-
下列原子结构示意图中,正确的是
A.
B.
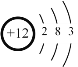 C.
C.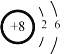 D.
D.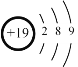
难度: 简单查看答案及解析
-
下列电子式或结构式错误的是
A.CCl4的电子式
B.NH4Br的电子式
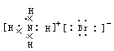
C.OH-的电子式
D.H2O的结构式为H-O-H
难度: 简单查看答案及解析
-
下列用电子式表示物质的形成过程正确的是
A.
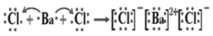
B.
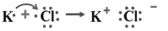
C.
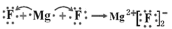
D.
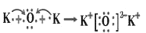
难度: 简单查看答案及解析
-
原子的种类决定于原子的
A.原子量大小 B.核内质子数和中子数 C.最外层电子数 D.核电荷
难度: 简单查看答案及解析
-
某粒子含有 6 个质子,7 个中子,电荷为 0,则它的化学符号是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
原子核外每个电子层上均含有2n2个电子的元素是( )
A.Be B.C C.Ar D.Ne
难度: 简单查看答案及解析
-
某元素原子 M 层电子数比 K 层电子数多 5 个,该元素的最高正价为
A.+7 B.+5 C.+3 D.无最高正价
难度: 简单查看答案及解析
-
元素 Y 的原子获得 3 个电子或元素 X 的原子失去 2 个电子后,它们的电子层结构都与氖原子的电子层结构相同。X、Y 两种元素的单质在高温下反应得到的化合物的化学式是
A.Y3X2 B.X2Y3 C.X3Y2 D.Y2X3
难度: 简单查看答案及解析
-
a、b、c、d、e 是同周期的五种元素,a 和 b 最高价氧化物对应的水化物呈碱性,且碱性 b>a,c 和 d 的气态氢化物的稳定性 c>d;五种元素的原子得失电子后形成的简单离子中 e 半径最小,下列叙述中正确的是
A.原子序数关系是 b<a<d<c<e B.离子半径关系是 d>c>e>b> a
C.原子半径关系是 a>b>e>d>c D.最外层电子数关系为 c>d>e>a>b
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断,其中正确的是
A.铊(Tl)是铝的同族元素,原子核外有 6 个电子层,推测 Tl(OH)3 是两性氢氧化物
B.砹(At)为有色固体,HAt 不稳定
C.已知锶 Sr 与镁同族,硫酸锶(SrSO4)是易溶于水的白色固体
D.硒化氢(H2Se)是比硫化氢稳定的气体
难度: 中等查看答案及解析
-
关于元素周期表(律)的下列叙述,错误的是
A.元素周期律揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.在周期表中,把原子电子层数相同的元素排成一横行,称为一周期
C.元素周期表中,总共有 18 个纵行,16 个族
D.第 IA 族的元素又称为碱金属元素,第 VIIA 族的元素又称为卤族元素
难度: 简单查看答案及解析
-
图是元素周期表的一部分(数字为原子序数),其中 x 为 35 的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
关于离子键、共价键的各种叙述中,下列说法中正确的是
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如 Cl2)中
C.原子序数为 11 与 9 的元素能够形成离子化合物,该化合物中存在离子键
D.任何物质中都存在化学键
难度: 简单查看答案及解析
-
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤
难度: 中等查看答案及解析
-
下列各组物质中,都是共价化合物的是( )
A.H2S和Na2O2 B.H2O2和CaF2 C.NH3和N2 D.HNO3和HClO3
难度: 简单查看答案及解析
-
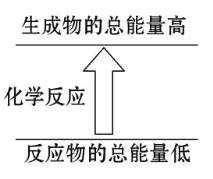
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.X和Y的总能量一定低于M和N的总能量
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.因为该反应为吸热反应,故反应一定要加热才能进行
难度: 简单查看答案及解析