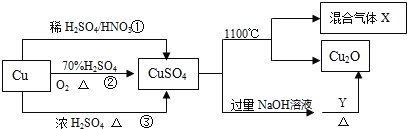
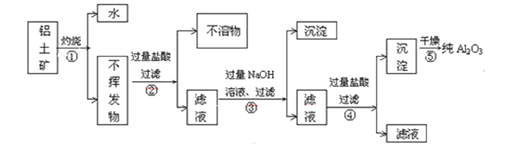
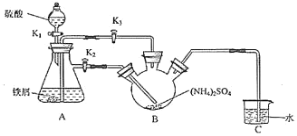
-
下列有关绿色化学的叙述中,不正确的是( )
A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染。
B.最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物。
C.绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的。
D.所有环境问题都是环境污染。
难度: 简单查看答案及解析
-
下列有关实验的内容正确的是( )
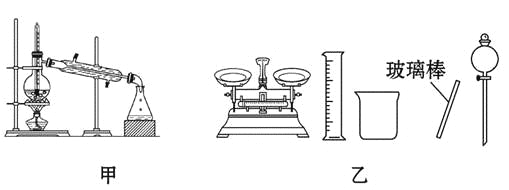
A.可用碱式滴定管量取12.85 mL的KMnO4溶液
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500 mL 0.4 mol/L NaCl溶液,必要的仪器如图乙所示
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.常温常压下,16 g O3和 O2的混合气体所含的氧原子数目为NA。
B.1 mol⋅L−1CaCl2溶液中含有的Cl−数目为2NA。
C.5.6 g Fe与足量盐酸反应失去的电子数目为0.3NA。
D.标准状况下,22.4 LSO3含有的分子数目为NA(用NA表示阿伏加德罗常数的值)。
难度: 简单查看答案及解析
-
下列各条件下可能共存的离子组是
A.某无色溶液中:NH4+、Na+、Cl-、MnO4-
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、SO32-、CO32-
C.在c(H+)=1×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
难度: 中等查看答案及解析
-
C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及化合物的说法中正确的是
A.三种元素在自然界中既有游离态又有化合态
B.二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应
C.最低价的气态氢化物都具有还原性,易与O2发生反应
D.其最高价氧化物对应水化物的酸性强弱:H2SO4>H2SiO3>H2CO3
难度: 中等查看答案及解析
-
下列说法正确的是:( )
A.硫和氯气与铁反应后铁元素的价态相同。
B.将SO2通入品红溶液中,溶液褪色,加热后无变化。
C.二氧化硫具有较强的还原性,故不能用浓硫酸干燥。
D.SO2能使酸性KMnO4溶液褪色,体现了SO2的还原性。
难度: 简单查看答案及解析