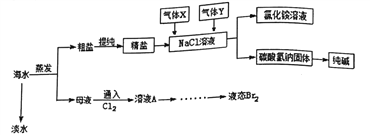
-
久置空气中会发生颜色变化,但颜色变化是由于跟氧气反应引起的物质是
A. 硫酸亚铁晶体 B. 亚硫酸钠固体 C. 过氧化钠固体 D. 氯水
难度: 简单查看答案及解析
-
下列与含氯化合物有关的说法正确的是
A. HClO是弱酸,所以NaClO是弱电解质
B. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C. 六水合氯化钙可用作食品干燥剂
D. 氯化铵、漂白粉都属于强电解质
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是
A. 1L1mol/L的氨水中含有NH3分子数为NA
B. 将1molFeCl3全部转化成胶体,其中氢氧化铁胶粒数为NA
C. 标准状况下,11.2LSO3所含的分子数为0.5NA
D. Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为0.1NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 铁片溶于足量稀硝酸:Fe+4H++NO3-=Fe2++NO2↑+2H2O
B. 少量SO2通入漂白粉溶液中:Ca2++3ClO-+SO2+H2O=CaSO4↓+2HClO+Cl-
C. 钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
D. AlCl3溶液与过量氨水反应:Al3++4OH-=AlO2-+2H2O
难度: 中等查看答案及解析
-
下列离子一定能够大量共存的是
A. 氢氧化铁胶体中:Na+、K+、S2-、Br-
B. 饱和FeCl3溶液:K+、NH4+、I-、Cl-
C. 含MnO4-的溶液中:Fe3+、Mg2+、SO42-、NO3-
D. 与铝作用生成H2的溶液中:Mg2+、K+、NO3-、Cl-
难度: 简单查看答案及解析
-
将1.52g铜镁合金完全溶解于50mL某浓度的硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),当向反应后的溶液中加入640mL 1.0mol/LNaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为2.54g。下列说法正确的是
A. 该合金中铜与镁的物质的量之比是1:2
B. 该硝酸中HNO3的物质的量浓度是14.0mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是20%
D. 该硝酸中HNO3的质量分数为60%
难度: 中等查看答案及解析
-
下列化学用语中正确的是
A. 水合钠离子的示意图:

B. NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
C. 表示某原子的结构示意图:
D. 带结晶水的碳酸钠的可能化学式:Na2CO3·3H2O
难度: 中等查看答案及解析
-
“分类”是一种思想,在化学发展中起到了重要作用。下列分类标准合理的是
A. 根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
B. 根据分子中的氢原子数将酸分为一元酸、二元酸和多元酸
C. 根据反应是否在溶液中进行将化学反应分为离子反应和非离子反应
D. 根据在水溶液中或熔融状态下能否导电,将化合物分为电解质和非电解质
难度: 简单查看答案及解析
-
化学与生产、生活息息相关,下列叙述错误的是
A. 二氧化硫可广泛用于食品的增白
B. 小苏打是面包发酵粉的主要成分之一
C. 燃烧化石燃料是造成雾霾天气的一种重要因素
D. 硅胶可用作食品干燥剂
难度: 简单查看答案及解析
-
下列有关用途的叙述错误的是
A. 常温下可用铁容器储运浓硫酸 B. 焰色反应可用于检验某些金属元素的存在
C. 氨是制造硝酸的原料 D. 铝制餐具可以长时间盛放咸的食物
难度: 简单查看答案及解析
-
下列各组物质: ①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与盐酸 ⑤Na与O2。由于条件不同而能发生不同氧化还原反应的是
A. 只有③④ B. 只有①③⑤ C. 只有①② D. 只有①③④⑤
难度: 中等查看答案及解析
-
下列表述正确的是
A. 二氧化硅是将太阳能转化变为电能的常用材料
B. 玻璃、水晶、玛瑙的主要成分都是硅酸盐
C. 水玻璃可用于生产黏合剂和防火剂
D. 二氧化硅既能跟HF反应,又能跟NaOH反应,因此二氧化硅是两性氧化物
难度: 简单查看答案及解析
-
能正确表示下列反应的化学方程式(或离子方程式)的是
A. 实验室制氨气:NH4++OH-
NH3↑+H2O
B. 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
C. 氢氧化亚铁的氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
D. 氯气与石灰乳反应:2Cl2+2Ca(OH)2=CaCl2+CaClO2+2H2O
难度: 中等查看答案及解析
-
在给定条件下,下列加点的物质在化学反应中几乎能被完全消耗的是
A. 大量NaClO溶液中通入少量CO2,密封,置于阳光下
B. 向100mL18mol·L-1的浓硫酸中加入64g铜
C. 标准状况下,将lg铝片投入20mLl8mol·L-1的硫酸中
D. 用50mL8mol·L-1浓盐酸与10g二氧化锰共热制取氯气
难度: 中等查看答案及解析
-
能通过化合反应生成的物质是
①Fe(OH)3 ②FeCl2 ③SO3 ④NH4Cl
A. 只有①② B. 只有②③④ C. 只有①②③ D. 全部
难度: 简单查看答案及解析
-
下列叙述正确的是
A. CO、CO2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B. 焰色反应、离子反应中都一定存在化学反应
C. 明矾溶于水能产生具有吸附性的胶体粒子,可作漂白剂
D. 可用浓盐酸检验输送氨气的管道是否漏气
难度: 中等查看答案及解析
-
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是
A. (NH4)3PO4 NaCl Na2SO4 MgCl2 (KOH溶液)
B. BaCl2 FeSO4 (NH4)2SO4 AlCl3 (氨水)
C. NH4HSO4 NH4Cl Na2CO3 MgCl2 (HNO3酸化的AgNO3溶液)
D. NaOH KSCN NaCl AlCl3 (FeCl3溶液)
难度: 中等查看答案及解析
-
下列实验现象描述正确的是
A. 将足量SO2气体通入石蕊试液中,石蕊试液变红色
B. 红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C. 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
D. 将过氧化钠加入足量的水中振荡,再滴入酚酞,振荡,溶液呈红色
难度: 中等查看答案及解析
-
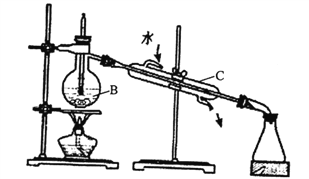
下列各图所示的实验原理、方法、装置和操作正确的是
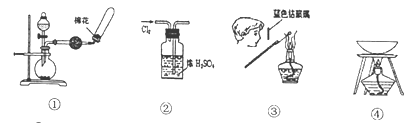
A. ①制备收集干燥的氨气 B. ②干燥Cl2
C. ③检验K2CO3中的K+ D. ④从KI和I2的固体混合物中回收I2
难度: 简单查看答案及解析
-
某溶液中可能合有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉定生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。下列叙述错误的是
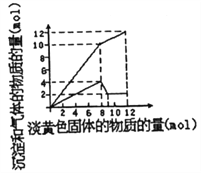
A. 溶液中一定含有的离子是NH4+、Al3+和Mg2+
B. 溶液中肯定不含有Cu2+,可能含有Fe2+
C. 所加的淡黄色固体是Na2O2
D. 溶液中的NH4+和Al3+的物质的量浓度之比3:1
难度: 中等查看答案及解析