-
化学在科技进步方面发挥着重要的作用。下列说法正确的是
A.
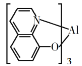 是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物B.2019世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC法能够实现直接从空气中捕获二氧化碳,该法可缓解全球日益严重的温室效应
D.以纯净物聚丙烯为原料生产的熔喷布口罩,在“新冠肺炎战疫”中发挥了重要作用
难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法正确的是
A.120gNaHSO4固体中含有H+的数目为NA
B.向FeBr2溶液中缓慢通入0.2molCl2时,被氧化的Fe2+数目一定为0.4NA
C.用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,阴极析出金属的质量大于6.4g
D.加热条件下,1molFe投入足量的浓硫酸中,生成SO2的分子数目为NA
难度: 中等查看答案及解析
-
某有机物结构简式如图,下列对该物质的叙述中正确的是
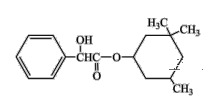
A.该有机物能发生取代反应、氧化反应和消去反应
B.1mol该有机物最多可与2molNaOH发生反应
C.该有机物可以与溴的四氯化碳溶液发生加成反应使之褪色
D.该有机物有3个手性碳原子
难度: 简单查看答案及解析
-
下列有关实验的操作、现象和结论都正确的是
选项
实验操作
现象
结论
A
向浓度均为0.10mol•L-1的KCl和KI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
B
向Na2SO3溶液中先加入Ba(NO3)2溶液,然后再加入稀盐酸
生成白色沉淀,加入稀
盐酸,沉淀不溶解
溶液已经变质
C
向盛有NH4Al(SO4)2溶液的试管中,滴加少量NaOH溶液
产生使湿润的红色石蕊试纸变蓝的气体
NH4++OH- = NH3↑+H2O
D
测定等物质的量浓度的Na2CO3和NaClO的pH值
Na2CO3>NaClO
酸性:H2CO3<HClO
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2019年化学诺贝尔奖授予拓展锂离子电池应用的三位科学家。如图是某锂—空气充电电池的工作原理示意图,下列叙述正确的是
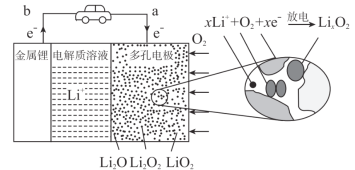
A.电解质溶液可选用可溶性锂盐的水溶液
B.电池放电时间越长,Li2O2含量越少
C.电池工作时,正极可发生Li++O2-e- = LiO2
D.充电时,b端应接负极
难度: 中等查看答案及解析
-
位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
难度: 中等查看答案及解析
-
向等物质的量浓度的K2S、KOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS−、S2−)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是
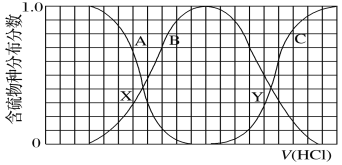
A.A曲线表示S2-随盐酸加入量增加时的分布分数改变情况
B.X、Y为曲线两交叉点。若已知Y点处的pH,则可计算Ka1(H2S)
C.X、Y点对应溶液中水的电离程度大小关系为:X<Y
D.Y点对应溶液中c(K+)与含硫各微粒浓度的大小关系为:c(K+)=3[c(H2S)+c(HS−)+c(S2−)]
难度: 中等查看答案及解析
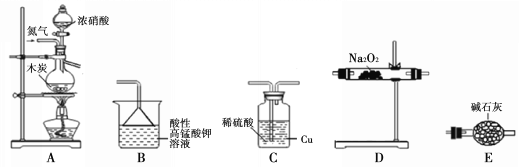
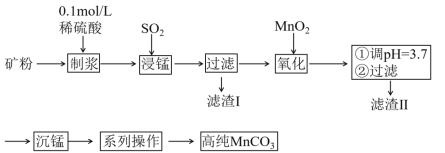

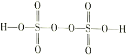 。在工业上用作强氧化剂。
。在工业上用作强氧化剂。
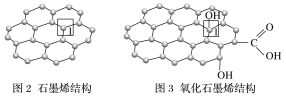
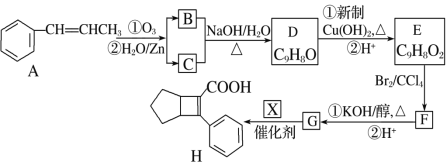
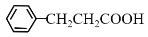 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。