-
在原子中,下列关系一定正确的是( )
A. 核内质子数=核电荷数
B. 原子序数=最外层电子数
C. 质子数>中子数
D. 原子序数=中子数
难度: 简单查看答案及解析
-
最新科技报道,美国夏威夷联合天文中心的科学家发现了新型的氢粒子,这种粒子是由3个氢原子核(没有中子)和2个电子构成。对这种粒子,下列说法中正确的是( )
A. 是氢的一种新单质 B. 是氢的一种新的同位素
C. 它的组成可用H3表示 D. 它比普通H2分子多一个氢原子核
难度: 简单查看答案及解析
-
下列说法中错误的是
A. 原子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从第ⅢB族到第ⅡB族的10列元素都是金属元素
C. 稀有气体元素原子的最外层电子数都是8个
D. 主族元素原子最外层电子数等于族序数
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 质子数相同的粒子一定属于同种元素
B. 原子序数相同的微粒电子数一定相同
C. 原子序数相同的两种粒子,性质一定相同
D. 电子数相同的粒子不一定是同一种元素
难度: 中等查看答案及解析
-
已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( )
A.钡可从氯化钠溶液中置换出金属钠
B.钡可从冷水中置换出氢气
C.钡可从硫酸铜溶液中置换出铜
D.在溶液中Ba2+可氧化金属锌,生成Zn2+
难度: 中等查看答案及解析
-
具有下列特征的元素,一定是短周期主族元素的是( )
A. 原子序数为20
B. 最外层只有2个电子
C. 元素原子的质子数为26
D. 最外层有3个电子的非金属元素
难度: 中等查看答案及解析
-
下列元素周期表族序数正确的是( )
A.第3列为ⅠB
B.第18列为0A
C.第14列为ⅣA
D.第8列为ⅧB
难度: 简单查看答案及解析
-
在元素周期表中,第一、二、三、四周期元素的种类分别是( )
A. 2、8、8、18 B. 2、8、18、18
C. 2、18、18、18 D. 2、8、18、32
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.氟、氯、溴原子的最外层电子数都是7,次外层电子数都是8
B.由HF、HCl、HBr、HI酸性增强,可知氟、氯、溴、碘非金属性增强
C.氟、氯、溴、碘的非金属性逐渐减弱是因为它们的电子层数逐渐增大
D.砹是原子序数最大的卤族元素,它易溶于水,难溶于四氯化碳
难度: 中等查看答案及解析
-
14C常用于测定生物遗骸的年份。下列说法正确的是
A.14C含有14个中子 B.14C与14N含有相同的质子数
C.14C与C60互为同位素 D.14C与12C是两种不同的核素
难度: 简单查看答案及解析
-
关于微粒半径大小的下列叙述中不正确的是( )
A.随原子序数的递增,同周期元素的原子半径逐渐减小(稀有气体除外)
B.随电子层数的递增,同主族元素的原子半径逐渐增大
C.电子层结构相同的离子,核电荷数越大,半径越大
D.同主族带相同电荷的离子,电子层数越多,半径越大
难度: 中等查看答案及解析
-
下列有关叙述中,能说明非金属元素M比N的非金属性强的是( )
①非金属单质N能从M的化合物中置换出非金属单质M;
②M原子比N原子容易得到电子;
③N-离子的还原性比M-离子强;
④气态氢化物水溶液的酸性HmM>HnN;
⑤氧化物水化物的酸性HmMOx>HnNOy;
⑥单质熔点M>N。
A.②⑤
B.②③
C.①②③
D.①②③⑤
难度: 中等查看答案及解析
-
下列关于元素周期表的叙述正确的是( )
A.在元素周期表中共有18个纵行,18个族
B.同族元素的最外层电子数一定相同
C.同周期元素的电子层数相同
D.每一周期的元素都是从碱金属元素开始,以稀有气体元素结束
难度: 中等查看答案及解析
-
X、Y是元素周期表ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
难度: 简单查看答案及解析
-
下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①③⑤
难度: 简单查看答案及解析
-
已知原子序数,可推断原子的是( )
①质子数②核电荷数③核外电子数④元素在周期表中的位置
A. ①②③ B. ①③④ C. ②③④ D. 全部
难度: 简单查看答案及解析
-
下列微粒半径大小比较正确的是( )
A.Na+<Mg2+<Al3+<O2-
B.Na+>Al3+>S2->Cl-
C.Na<Mg<Al<S
D.Na<K<Rb<Cs
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 中等查看答案及解析
-
下列化合物中阴离子半径和阳离子半径之比最大的是( )
A. LiI B. NaBr C. KCl D. CsF
难度: 中等查看答案及解析
-
在元素周期表中,对于相同主族相邻周期的两种元素原子序数之差的叙述正确的是( )
A.第2、3周期两元素相差均为8
B.第3、4周期两元素相差均为18
C.第5、6周期两元素相差均为32
D.以上叙述均正确
难度: 简单查看答案及解析
-
门捷列夫编制的第一张元素周期表,为元素的发现和研究元素性质铺平了道路,当时门捷列夫编排元素先后顺序的依据是( )
A. 原子半径 B. 原子序数
C. 相对原子质量 D. 质子数
难度: 简单查看答案及解析
-
X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示。已知X、Y、Z三种元素的质子数之和为40,则X、Y、Z分别是

A.N、S、Cl
B.B、Si、P
C.C、P、S
D.Be、Al、Si
难度: 中等查看答案及解析
-
元素A、B、C、D在周期表中的位置如图所示:
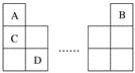
下列叙述中不正确的是( )
A.C的原子序数比B的原子序数大1
B.原子结构示意图为
的元素,与C位于同一周期
C.B的原子与D的原子最外层电子数相等
D.原子结构示意图为
的元素,与B位于同一主族
难度: 中等查看答案及解析
-
某元素的原子结构示意图为
。下列关于该元素的叙述不正确的是
A.原子序数为15
B.原子核外有3个电子层
C.是一种金属元素
D.位于第三周期第ⅤA族
难度: 简单查看答案及解析
-
下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显
价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④ B.①③⑤ C.②④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
金属元素钫(Fr)在自然界中含量极少。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )。
A.在已知碱金属元素中具有最大的原子半径
B.在空气中燃烧时生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱
D.其单质的熔点比金属钠的熔点低
难度: 中等查看答案及解析
-
氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A.(CN)2和NaOH溶液反应:(CN)2+2OH-=== CN-+CNO-+H2O
B.MnO2和HCN反应:MnO2+4HCN(浓)
Mn(CN)2+(CN)2↑+2H2O
C.向KCN溶液中加入碘水:I2+2KCN === 2KI+(CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=== 2Cl-+(CN)2
难度: 中等查看答案及解析
-
已知R2-的核内有n个中子,R原子的质量数为M,则mg R2-中含有电子的物质的量为
A.
mol B.
mol C.
mol D.
mol
难度: 简单查看答案及解析
-
某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则表示R原子组成符号正确的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
X-的核外电子排布为2、8、8,则X元素在周期表中的位置是( )
A.第三周期第0族 B.第四周期第ⅠA族
C.第三周期第ⅦA族 D.第三周期第ⅠA族
难度: 中等查看答案及解析
-
已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质.氟元素原子的核外电子排布示意图为
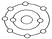 ,下列原子中,与氟元素原子的化学性质相似的是( )
,下列原子中,与氟元素原子的化学性质相似的是( )A.
B.
C.
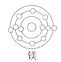 D.
D.
难度: 中等查看答案及解析
-
甲、乙两种非金属: ①甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;②甲比乙更容易与氢气化合;③甲单质能与乙的简单阴离子发生置换反应;④与金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是
A.①②④ B.①②③④ C.①②③ D.②③④⑤
难度: 中等查看答案及解析
-
将甲、乙两种金属的性质相比较,已知:①甲与H2O反应比乙与H2O反应剧烈;②单质甲能从乙的盐酸溶液中置换出单质乙;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④与某非金属反应时甲原子失电子数目比乙原子失电子数目多;⑤甲单质的熔,沸点比乙的低;⑥高价阳离子氧化性甲比乙弱。能说明甲的金属性比乙强的是
A.①④
B.①②③⑥
C.③⑤
D.①②③④⑤
难度: 中等查看答案及解析
-
元素性质呈周期性变化的根本原因是
A.元素原子质量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化
难度: 简单查看答案及解析
-
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是
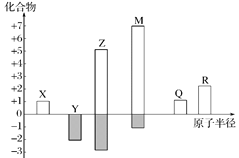
A.Q位于第三周期ⅠA族
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.简单离子半径:M->Q+>R2+
D.Z与M的最高价氧化物对应水化物均为强酸
难度: 困难查看答案及解析
-
该图为周期表中短周期的一部分。已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是
A.a的最高价氧化物对应水化物有两性
B.b与d组成的化合物不能与水反应
C.c的单质能与强碱反应生成两种盐
D.非金属性:c>d>b>a
难度: 中等查看答案及解析