-
下列说法正确的是
A. 自发反应在任何条件下都能实现
B. 1/2 molH2SO4和1/2 molBa(OH)2完全中和所放出的热量为中和热
C. 同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同
D. 熵增加的放热反应一定能自发进行
难度: 简单查看答案及解析
-
已知25℃、101kPa条件下:4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2834.9 kJ/mol
4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3119.1 kJ/mol
由此得出的结论正确的是
A. 等质量的O2比O3能量低,由O2变O3为吸热反应
B. 等质量的O2比O3能量低,由O2变O3为放热反应
C. O3比O2稳定,由O2变O3为吸热反应
D. O2比O3稳定,由O2变O3为放热反应
难度: 中等查看答案及解析
-
已知在101kPa时:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-820 kJ·mol-1 。下列说法正确的是
A. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH>-820 kJ·mol-1
B. CH4的燃烧热是820 kJ
C. 1mol CH4和2mol O2的键能之和大于1mol CO2和2mol H2O的键能之和
D. 11.2L(标准状况)CH4完全燃烧生成气态水时放出410kJ热量。
难度: 中等查看答案及解析
-
当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是
①N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g)===2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g)===
N2(g)+
H2(g) ΔH=+46.2 kJ/mol
④2NH3(g)===N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A. ①③ B. ②④ C. ②③ D. ①④
难度: 中等查看答案及解析
-
下列离子或分子组中能大量共存,且满足相应要求的是
选项
离子或分子
要求
A
K+、NO3-、Cl-、HS-
c(K+)<c(Cl-)
B
Fe3+、NO3-、SO32-、Cl-
滴加盐酸立即有气体产生
C
NH4+、Al3+、SO42-、CH3COOH
滴加NaOH溶液立即有气体产生
D
Na+、HCO3-、Mg2+、SO42-
滴加氨水立即有沉淀产生
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
难度: 中等查看答案及解析
-
已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是
A.每生成2分子AB吸收bkJ热量
B. 该反应热△H= +(a-b)kJ/mol
C.加入催化剂,该化学反应的反应热变大D. 断裂1molA—A和1molB—B键,放出akJ能量
难度: 中等查看答案及解析
-
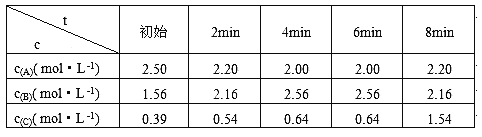
某反应:2A(g)
3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
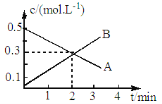
A、v(A)=0.1mol/(L.min) B、v(B)=0.2mol/(L.min)
C、v(A)= v(B) =0.5 mol/(L.min) D、v(A)= v(B) =0.3 mol/(L.min)
难度: 中等查看答案及解析
-
可逆反应A(g)+B
C(g)+D,达到平衡时,下列说法不正确的是
A. 若B是气体,增大A的浓度会使B转化率增大
B. 若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体
C. 升高温度,C百分含量减少,说明正反应是放热反应
D. 增大压强,平衡不移动,说明B是气体
难度: 中等查看答案及解析
-
有两个极易导热的密闭容器a和b(如图所示),a容器体积恒定,b容器压强恒定。在同温同压和等体积条件下,向a和b两容器中通入等物质的量的NO2,发生反应: 2NO2
N2O4 △H<0,则以下说法正确的是
A. 反应起始时两容器的反应速率va和vb的关系:va<vb
B. 反应过程中两容器内的反应速率va和vb的关系:va<vb
C. 反应达到平衡时,两容器内压强相同
D. 反应达到平衡时,两容器的NO2的转化率相同
难度: 中等查看答案及解析
-
在密闭容器中,反应X2(g)+Y2(g)
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
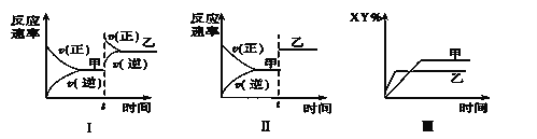
A.图Ⅰ是增大压强的变化情况
B.图Ⅱ是一定是加入催化剂的变化情况
C.图Ⅲ是增大压强或升高温度的变化情况
D.图Ⅲ一定是升高温度的变化情况
难度: 中等查看答案及解析
-
把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
A. 5min内P的平均反应速率为0.15mol/(L·min)
B. Q的平衡浓度为1mol/L
C. Q的转化率为25%
D. x是2
难度: 极难查看答案及解析
-
从下列实验事实所引出的相应结论正确的是 ( )
选项
实验事实
结论
A
其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短
当其他条件不变时,增大反应物浓度化学反应速率加快
B
在化学反应前后,催化剂的质量和化学性质都没有发生改变
催化剂一定不参与化学反应
C
物质的量浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应
反应开始速率相同
D
在容积可变的密闭容器中发生反应H2(g)+I2(g)
2HI(g),把容积缩小一倍
正反应速率加快,逆反应速率不变
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
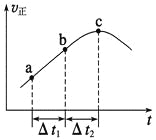
A. 反应在c点达到平衡状态
B. 反应物浓度:a点小于b点
C. 反应物的总能量低于生成物的总能量
D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
难度: 简单查看答案及解析
-
加热N2O5依次发生的分解反应为:
①N2O5(g)
N2O3(g)+O2(g)
②N2O3(g)
N2O(g)+O2(g)
在容积为2 L的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol。则平衡体系中N2O5的物质的量浓度为
A. 1.8mol/L B. 0.9 mol/L C. 2.3 mol/L D. 4.0 mol/L
难度: 困难查看答案及解析