-
化学与生产、生活、科技、环境等密切相关。下列说法正确的是 ( )
A.“华为麒麟980”手机中芯片的主要成分是二氧化硅
B.豆腐有“植物肉”之美称,“卤水点豆腐”是胶体的聚沉过程
C.港珠澳大桥为了防腐蚀可以在钢铁中增加含碳量
D.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是碳酸钠
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
B.18 g氨基(-ND2)中含有的电子数为10NA
C.用惰性电极电解100 mL 0.1 mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0. 04NA
D.工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
难度: 中等查看答案及解析
-
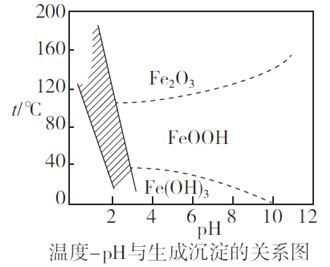
ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
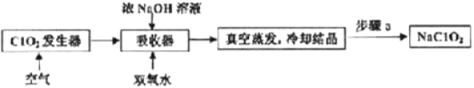
下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
难度: 中等查看答案及解析
-
PET(
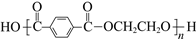 ,M链节= 192 g·mol−1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L−1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol−1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L−1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度
(忽略端基的摩尔质量)
难度: 简单查看答案及解析
-
2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为Li1-xCoO2+LixC6
LiCoO2+C6(x<l)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸,工作原理如图所示(注明:酸化电解后的苯甲酸盐可以析出苯甲酸)。
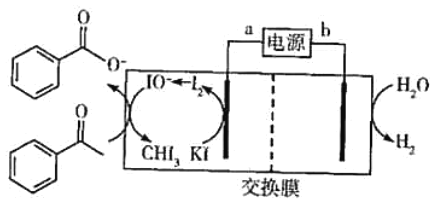
下列说法正确的是( )
A.锂离子电池的a极为负极
B.放电时,正极反应式为xLi++xe-+Li1-xCoO2=LiCoO2
C.交换膜为质子交换膜
D.每产生4.48LH2(标准状况),生成0.4molIO-
难度: 中等查看答案及解析
-
化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
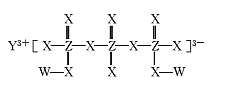
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
难度: 中等查看答案及解析
-
将浓度均为0.5mol∙L-1氨水和KOH溶液分别滴入到体积均为20mL且浓度相同的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示,下列说法中错误的是( )
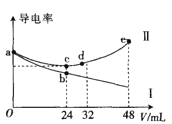
A.AlCl3溶液的物质的量浓度为0.2mol∙L-1
B.根据图象可以确定导电率与离子种类有关
C.cd段发生的反应是Al(OH)3+OH-=AlO2-+2H2O
D.e点时溶液中的离子浓度:c(K+) =c(Cl-) +c(AlO2-)
难度: 中等查看答案及解析

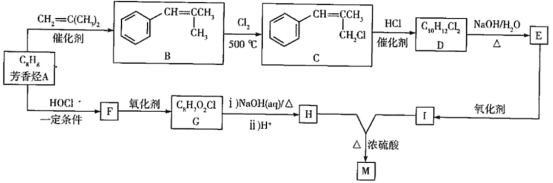
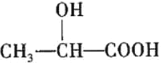 )在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以2-丁烯和乙烯为原料合成乳酸,设计合成路线___(无机试剂任选)。
)在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以2-丁烯和乙烯为原料合成乳酸,设计合成路线___(无机试剂任选)。