-
化学创造了丰富的物质世界,指导着我们的生产、生活。下列说法正确的是
A.超级电容器材料石墨烯属于烯烃
B.钙钛矿太阳能电池和锂离子电池的工作原理相同
C.服用阿司匹林(
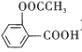 )出现水杨酸反应时用小苏打解毒
)出现水杨酸反应时用小苏打解毒D.利用双氧水和75%乙醇的强氧化性消杀新冠病毒
难度: 中等查看答案及解析
-
八角油是良好的天然香料和食品调料,其主要成分茴香脑的结构简式如图所示。下列关于苗香脑的说法错误的是
A.难溶于水,易溶于乙酸乙酯
B.属于烃的衍生物,与
互为同系物
C.1mol 该分子最多能与4mol H2发生加成反应
D.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.11g B所含中子数为NA
B.标准状况下,11.2L Cl2溶于水充分反应转移的电子数为NA
C.25℃,27g Al与足量的18.4mol/L的硫酸反应,产生SO2分子数为1.5NA
D.常温常压下,3.0g 溶有甲醛(HCHO)的冰醋酸中,氧原子总数为0.1NA
难度: 简单查看答案及解析
-
下列实验设计不合理的是
A.
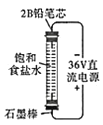 自制“84”消毒液
自制“84”消毒液B.
 利用喷泉实验探究NH3的部分性质
利用喷泉实验探究NH3的部分性质C.
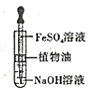 制备Fe(OH)2白色沉淀
制备Fe(OH)2白色沉淀D.
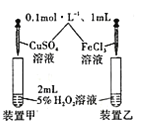 探究不同催化剂对双氧水分解速率的影响
探究不同催化剂对双氧水分解速率的影响难度: 中等查看答案及解析
-
在“宏观——微观——符号”之间建立联系是化学学科特有的思维方式。如图是科研人员提出的HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程示意图(图中只画出了HAP的部分结构)。下列说法不正确的是
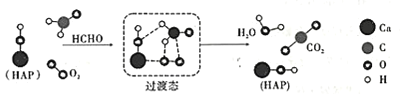
A.HAP能降低HCHO与O2反应的活化能
B.该反应的化学方程式为HCHO+O2
CO2+H2O
C.反应过程中断裂或生成的的化学键类型均为极性共价键
D.产物CO2分子中的氧原子不仅仅来源于O2
难度: 中等查看答案及解析
-
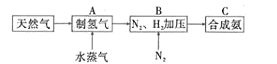
1980年,古迪的夫发明了钴酸锂材料,这种材料的结构可以使锂离子在其中快速移动。以LiCoO2作电极材料的锂离子电池在充、放电时的微观粒子变化如图所示,下列说法正确的是
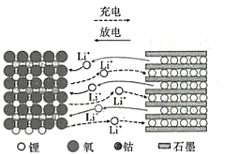
A.LiCoO2是电池的负极材料
B.充电时,LiCoO2电板的电势低于石墨电极
C.充电时,阳极发生的反应是LiCoO2+xe-=Li1-xCoO2+xLi+
D.放电时,当1mol电子转移,则石墨电极质量减少7g
难度: 中等查看答案及解析
-
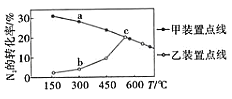
某课外研究小组设计数字化实验探究温度对盐类水解反应的影响。通过加热50mL 0.1000mol/L的Na2CO3标准溶液进行实验,测得溶液的pH随温度变化的关系如图所示,下列说法不正确的是

A.由ab段可得结论:CO32-(aq)+H2O(l)⇌HCO3-(aq)+OH-(aq) ∆H>0
B.e点溶液中:(OH- )=c(H+)+c( HCO3-)+2c( H2CO3)=1×10-3.35mol/L
C.bd段pH减小是水的Kw随着温度的升高而增大所致
D.从a→d随着温度升高,
始终增大
难度: 困难查看答案及解析


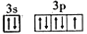 B. [Ne]
B. [Ne] 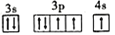
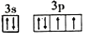 D. [Ne]
D. [Ne] 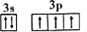
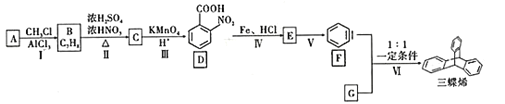
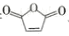 、KOH溶液除去三蝶烯中溶有的化合物G。化合物G最终生成溶于水的物质______(填结构简式)而除去。
、KOH溶液除去三蝶烯中溶有的化合物G。化合物G最终生成溶于水的物质______(填结构简式)而除去。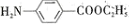 )的合成路线______ (无机试剂任选):
)的合成路线______ (无机试剂任选):