-
北宋《本草图经》中载有:“绿矾形似朴消(Na2SO4·10H2O)而绿色,取此一物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出色赤如融金汁者,是真也。”下列对此段话的理解正确的是
A.朴消是黑火药的成分之一 B.上述过程发生的是置换反应
C.此记载描述的是鉴别绿矾的方法 D.“色赤”物质可能是单质铜
难度: 中等查看答案及解析
-
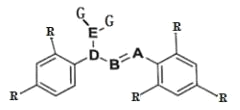
有机物 X 的结构简式如图所示,下列有关说法错误的是
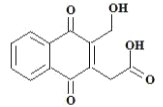
A.X 的分子式为 C13H10O5
B.X 分子中有五种官能团
C.X 能使溴的四氯化碳溶液褪色
D.X 分子中所有碳原子可能共平面
难度: 中等查看答案及解析
-
NA 代表阿伏加德罗常数的值。下列叙述正确的是
A.46g 乙醇中存在的共价键总数为 7NA
B.34g 硫化氢在足量的氧气中燃烧转移电子总数为 8NA
C.标准状况下,22.4LHF 含有的原子数为 2NA
D.64gCaC2 晶体中阴离子和阳离子总数为 2NA
难度: 中等查看答案及解析
-
下列对实验现象的解释正确的是
选项
操作
现象
解释
A
将铜粉加入 Fe2(SO4)3溶液中
溶液变蓝
金属铁比铜活泼
B
铜与浓硫酸共热
有灰白色固体生成
浓硫酸具有强氧化性和吸水性
C
氧化铁溶于足量 HI 溶液
溶液呈棕黄色
Fe3+呈 棕黄色
D
向待测液中加 入适量的NaOH溶液,将湿润的红色石蕊试纸放在试管口
湿润的红色石蕊试纸未变蓝
待测液中不存在NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z 为原子序数依次增大的短周期主族元素。元素W 分别与元素 X、Y、Z 结合形成质子数相同的甲、乙、丙三种分子。反应②是工业制硝酸的重要反应,乙与丙的混合物不能用玻璃瓶盛装。上述物质有如图所示的转化关系:
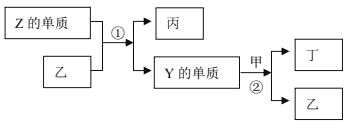
下列说法错误的是
A.甲是易液化气体,常用作致冷剂
B.可以用甲在一定条件下消除丁对环境的污染
C.甲、丙分子可以直接化合生成离子化合物
D.丁是一种红棕色气体,是大气主要污染物之一
难度: 中等查看答案及解析
-
常温下,将 1molCaC2O4 粉末置于盛有500mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3 固体的过程中,溶液中Ca2+ 和 CO32-的浓度变化曲线如图所示,下列说法中不正确的是
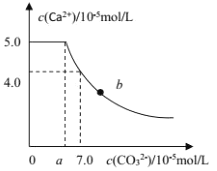
A.a=5.6
B.常温下,Ksp(CaC2O4)>Ksp(CaCO3)
C.b 点对应的溶液中,离子浓度关系为c(C2O42-) <c(CO32-)
D.若使 1molCaC2O4 全部转化为 CaCO3,至少要加入 2.12molNa2CO3
难度: 困难查看答案及解析
-
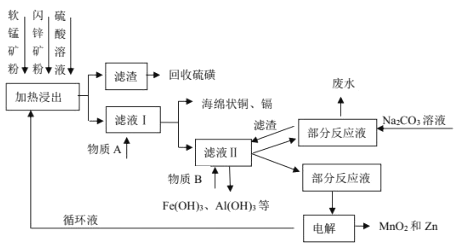
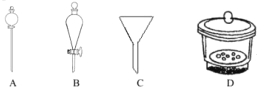
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃)。某苯甲酸晶体 中含少量可溶性杂质X和难溶性杂质Y。现拟用下列装置和操作进行提纯:装置:
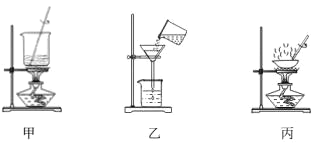
操作:①常温过滤②趁热过滤③加热溶解④结晶⑤洗涤、干燥下列有关说法正确的是_________
A.用甲装置溶解样品,X 在第①步被分离
B.用乙装置趁热过滤,Y 在第②步被分离
C.用丙装置所示的方法结晶
D.正确的操作顺序为:③→④→②→①→⑤
难度: 中等查看答案及解析

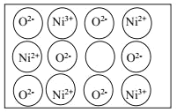
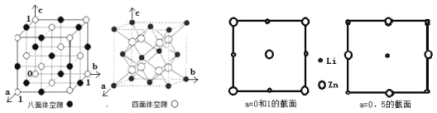
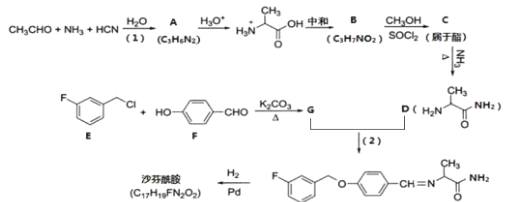
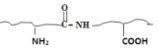 表示)。
表示)。