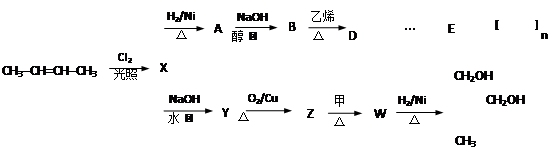
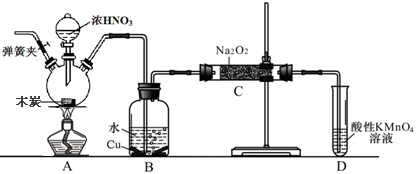
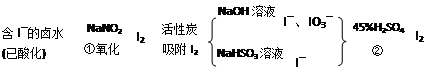-
燃煤是影响空气质量的主要原因之一。下列有关叙述错误的是
A.煤主要含碳及少量的氢、氮、硫、氧等元素
B.煤的干馏、液化都是化学变化
C.将煤气化后再燃烧可降低污染
D.生石灰和煤混合燃烧生成CaSO4是减少燃煤产生SO2的唯一方法
难度: 中等查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是
A.1H与D互称同位素 B.1H→D通过化学变化不能实现
C.H2O与D2O互称同素异形体 D.1H218O与D216O的物理性质不同
难度: 中等查看答案及解析
-
下列对化学用语的叙述正确的是
A.碳原子最外层电子云有三种不同的伸展方向
B.CCl4 的比例模型
C.氮分子的结构式:N≡N:
D.溴化铵的电子式:
难度: 中等查看答案及解析
-
下列各物质的命名正确的是
A.2-乙基戊烷 B.油酸甘油脂 C.1,3,5-三硝基甲苯 D.2,2-二甲基-1-丙醇
难度: 中等查看答案及解析
-
不能比较氮和氧非金属性相对强弱的是
A.氨气在氧气中燃烧生成氮气 B.沸点:H2O>NH3
C.NO中N为+2价,氧为-2价 D.热稳定性:H2O>NH3
难度: 中等查看答案及解析
-
下列现象或操作与溶解度或溶解度的变化无关的是
A.液溴保存时用水封 B.合成氨工业中将N2、H2和NH3中氨分离
C.苯酚溶液置于冰水浴中变浑浊 D.重结晶法分离氯化钠和氯化钾
难度: 中等查看答案及解析
-
一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2
CO2+H2O,该反应
A.反应物和生成物中都含极性分子和非极性分子
B.生成1.8gH2O消耗2.24L O2
C.反应时有极性键和非极性键的断裂和它们的生成
D.为吸热反应
难度: 中等查看答案及解析
-
CO(g)+H2O(g)
CO2(g)+H2(g)+Q,将1molCO和1molH2O置于密闭容器中发生上述反应,其他条件不变的情况下,下列叙述正确的是
A.加入催化剂,改变了反应的途径,反应放出的热量也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若将该反应设计成原电池,反应放出的热量不变
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,对该反应的分析,错误的是
A.反应前后物质中阴、阳离子数目保持不变
B.反应前后总物质的量减少0.5mol
C.反应中转移了NA电子并生成了11.2L氧气
D.反应的二氧化碳和生成的氧气体积比为2:1
难度: 中等查看答案及解析
-
下列鉴别方法不可行的是
A.用水鉴别乙醇、甲苯和溴苯
B.用KMnO4(H+)溶液鉴别苯、环已烯和环已烷
C.用燃烧法鉴别乙醇、苯和四氯化碳
D.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示。仅用此装置和表中提供的物质完成相关实验,最合理的是

选项 a中物质 b中物质 c中收集的气体 d中物质
A 浓氨水 CaO NH3 H2O
B 浓硫酸 Na2SO3 SO2 NaOH溶液
C 饱和食盐水 电石 CH≡CH H2O
D 浓盐酸 MnO2 Cl2 NaOH溶液
难度: 中等查看答案及解析
-
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加下图所示的试剂
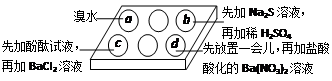
对实验现象的“解释或结论”错误的是
选项 实验现象 解释或结论
A a中溴水褪色 还原性:SO32—> Br—
B b中加硫酸后产生淡黄色沉淀 SO32—和S2—在酸性条件下发生反应
C c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 SO32—+H2O
HSO3—+OH—,所以滴入酚酞变红;
Ba2++SO32—→BaSO3↓(白),使水解平衡左移,红色褪去
D d中产生白色沉淀 Na2SO3溶液已被氧化变质
难度: 中等查看答案及解析
-
硝酸盐不稳定,一般受热分解会放出氧气,下列硝酸盐分解可能不会产生氧气的是
A.硝酸钠 B.硝酸亚铁 C.硝酸铵 D.硝酸铜
难度: 中等查看答案及解析
-
下列有关元素的性质及其递变规律正确的是
A.Ⅰ A族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
难度: 中等查看答案及解析
-
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
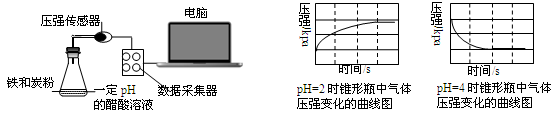
分析图像,以下结论错误的是
A.溶液pH≤2时,生铁发生析氢腐蚀 B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快 D.两溶液中负极反应均为:Fe – 2e→Fe2+
难度: 中等查看答案及解析
-
25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则

A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO―)>c(Na+)
C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
D.M点和N点所示溶液中H2O的电离程度相同
难度: 中等查看答案及解析
-
有A、B、C、D、E五种化合物0.1mol/L的溶液,它们的阳离子有K+、Ag+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、NO3-、SO42-、CO32-,将它们进行如下实验:①溶液A、D呈碱性,且碱性为A>D;②向B溶液中滴加稀氨水至过量,先出现沉淀,后沉淀消失;③向E溶液中滴加氨水,生成白色沉淀,沉淀最终变为红褐色
A.实验①能确定A和D的化学式 B.实验②能确定B中含Al3+
C.实验③能确定E的化学式 D.上述实验能确定这五种化合物的化学式
难度: 困难查看答案及解析
-
下列事实不能用平衡移动原理解释的是



A B C D
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列判断合理的是
A.元素W分别与X、Y、Z形成的化合物都是离子化合物
B.四种元素简单离子的半径:X < Y < Z < W
C.Z与其他三种元素形成的常见化合物中有离子晶体、原子晶体和分子晶体
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
在恒容密闭容器进行的可逆反应:MgSO4(s) + CO(g)
MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
A.若平衡常数K值变大,平衡移动时v逆先减小后增大
B.容器中固体物质的质量不再改变,则反应到达平衡状态
C.若x表示温度,y可表示平衡时混合气体的密度
D.若x表示CO物质的量,y可表示平衡时CO2与CO物质的量之比
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.用惰性电极电解饱和食盐水:2Cl-+2H2O
Cl2↑+H2↑+2OH-
B.苯酚与碳酸钠溶液:
+ CO32—→
+ H2CO3
C.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++ 3SO42-+ 3Ba2++6OH-→3BaSO4↓+ 2Fe(OH)3↓
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3→2FeO42-+3Cl-+ H2O+4H+
难度: 中等查看答案及解析
-
NH3和Cl2可快速反应:2NH3+3Cl2 →N2+6HCl 。有100LNH3和Cl2混合气体,充分反应后的混合气体中N2占混合气体的1/7,则N2的物质的量为(标准状况下数据)
A.0.263 mol B. 0.483 mol C.0.663 mol D.0.893 mol
难度: 中等查看答案及解析