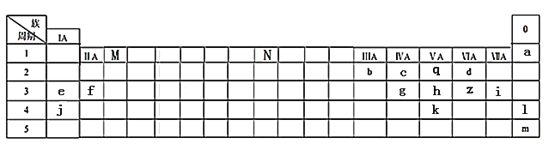
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是( )
①a-b=m-n;②元素的原子序数a>b>c>d;③元素非金属性Z>R;④最高价氧化物对应水化物的碱性X>Y
A. ①②③ B. ②③ C. ③ D. ①②③④
难度: 中等查看答案及解析
-
下列有关环境问题的说法不正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的含量
B.京津冀、长三角、珠三角雾霾的形成与煤的燃烧、化工厂大量排放含硫、含氮氧化物、颗粒物和汽车排放的尾气等有关
C.pH小于7.0的降雨通常称为酸雨
D.使用洁净能源、为汽车安装尾气转化装置、对硝酸厂排放的废气进行碱处理能有效控制氮氧化物对空气的污染。
难度: 简单查看答案及解析
-
下列图示关系不正确的是( )
A.
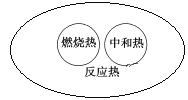 B.
B.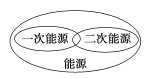
C.
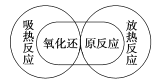 D.
D.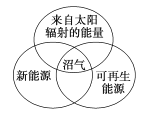
难度: 简单查看答案及解析
-
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:
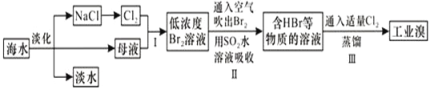
A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
难度: 中等查看答案及解析
-
下列有关化学与自然资源的开发利用描述中错误的是
A.生物质能本质上是太阳能
B.火法炼铜的反应为:CuS+O2
Cu+SO2
C.用
作为燃料的优点之一是燃烧后的产物不污染环境
D.由铝土矿
主要含Al2O3,还含有Fe2O3、SiO2等杂质
冶炼金属铝的过程中,涉及复分解反应和分解反应
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.次氯酸的电子式:
B.Mg原子的结构示意图:
C.硫化钠的电子式:
D.
的结构示意图为

难度: 简单查看答案及解析
-
下列说法不正确的是
A.CCl4、SiO2都存在共价键,都是共价化合物
B.H2O比H2S稳定是因为
分子之间存在氢键
C.某物质在熔融状态能导电,则该物质中不一定含有离子键
D.
溶于水时,需克服共价键和分子间作用力
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.01 mol·L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01NA
B.在标准状况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
C.0.1 mol Cu与含0.2mol H2SO4的浓硫酸完全反应后,溶液中Cu2+数目为0.1NA
D.2.0 g D2O中含有的质子数、电子数均为NA
难度: 简单查看答案及解析
-
肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ/mol
反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ/mol
下列说法不正确的是( )
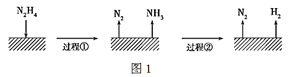
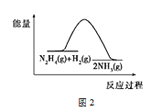
A.图1所示过程①是放热反应,②是吸热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为:N2H4(g)= N2(g)+2H2(g) ΔH=-50.7 kJ/mol
难度: 简单查看答案及解析
-
主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X—的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂,Z3+和Y2—具有相同的电子层结构,T、W、Y三种元素组成的盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是( )
A.原子半径:T>R>W>Z
B.X和R形成化合物的水溶液呈酸性
C.单质T具有很强的还原性,可与水反应
D.T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应
难度: 中等查看答案及解析
-
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号
A
B
C
D
E
N
G
原子半径
主要化合价
、
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.
的最高价氧化物的水化物溶液的pH:
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34 g·mol-1,Y的最低价氢化物为非电解质。则下列说法中正确的是( )
X
Y
Z
W
Q
A.氢化物的稳定性:W<Q
B.X的最低价氢化物水溶液显酸性
C.Q单质能溶于水,且水溶液须用棕色细口瓶盛装
D.Na与Y能形成共价化合物Na2Y2
难度: 简单查看答案及解析
-
1993年8月,国际原子量委员会确认我国张青莲教授测定的51号元素的原子量
为该元素的标准原子量,已知该元素有两种以上天然同位素。正确的是
A.
是该元素的质量与一个
原子质量
的比值
B.该元素为金属元素
C.该元素位于第六周期、第ⅤA族
D.该元素原子含有51个中子
难度: 简单查看答案及解析
-
短周期元素X、Y、Z的原子序数之和为22,且Y2-与Z3+核外电子排布相同。下列化合物中同时存在极性共价键和非极性共价键的是( )
A.X2Y2 B.X2Y C.Z2Y3 D.X3ZY3
难度: 简单查看答案及解析
-
短周期元素a、b、c、d的原子序数依次增大。a和c位于同主族,b和d位于同主族,c为短周期元素中原子半径最大的原子。X、Y两种化合物均含这四种元素,常温下,0.1 mol·L-1 Y溶液的c(H+)=0.1mol/L。在X溶液中滴加Y溶液,产生气体的物质的量与加入的Y溶液中Y的物质的量的关系如图所示(假设溶液中气体全部逸出)。下列说法正确的是( )
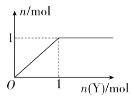
A.简单离子半径:d>c>b
B.气态氢化物的热稳定性:d>b
C.c2b2中含两种化学键
D.X、Y溶液中滴加氯化钡溶液都会产生白色沉淀
难度: 简单查看答案及解析
-
中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是( )

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能用于做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2和N2O4的混合气体做喷泉实验,烧瓶中将充满稀硝酸
难度: 中等查看答案及解析
-
表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
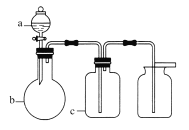
选项
气体
a
b
c
A
NH3
浓氨水
生石灰
碱石灰
B
SO2
70%的浓H2SO4
Na2SO3固体
98%的浓H2SO4
C
NO
稀HNO3
铜屑
H2O
D
NO2
浓HNO3
铜屑
NaOH溶液
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
锗(位于第4周期ⅣA族)和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是( )
A.锗不能与强碱反应 B.氢氧化锗具有两性
C.氧化锗易溶于水 D.氧化锗的化学式为Ge2O3
难度: 简单查看答案及解析
-
为研究某铁钉与浓硫酸反应生成气体Y的成分,某学习小组做出假设,认为所得气体中除含有SO2外,还可能含有H2和Q气体,并设计了下列实验装置(图中夹持仪器省略)探究气体的成分,为确认Q的存在,需在装置中添加M于( )
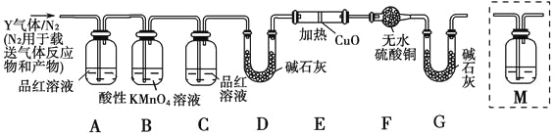
A.A-B之前 B.B-C间 C.C-D间 D.D-E间
难度: 中等查看答案及解析
-
某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+ (aq)+
O2(g)===NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol
②NO2- (aq)+
O2(g)===NO3- (aq) ΔH=-73 kJ/mol。下列叙述正确的是 ( )
A.上述反应条件下,NH4+比NO3-稳定
B.0.1 mol NH3比0.1 mol NH4+含有的电子数少
C.反应①中0.1 mol NH4+被氧化时,有0.6 mol e-转移
D.NH4+ (aq)+2O2(g)===NO3- (aq)+2H+(aq)+H2O(l) ΔH=-200 kJ/mol
难度: 简单查看答案及解析
-
1 L 0.5 mol·L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量;1 L 0.5 mol·L-1 HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;则500 mL 0.4 mol·L-1 BaCl2溶液与足量稀硫酸反应放出的热量为( )
A.0.4(a+2b) kJ B.0.4(a-2b) kJ
C.0.2(a-2b) kJ D.0.2(a+2b) kJ
难度: 中等查看答案及解析
-
三硫化四磷用于制造火柴等,可由白磷和单质硫化合而得。它们的结构如下:

依据下列键能数据,反应8P4(s)+3S8(s)=8P4S3(g)的ΔH为( )
化学键
P—P
S—S
P—S
键能/kJ·mol-1
a
b
c
A.24(a+b-2c) kJ·mol-1 B.(32a+24b-24c) kJ·mol-1
C.(48c-24a-24b) kJ·mol-1 D.(8a+3b-3c) kJ·mol-1
难度: 简单查看答案及解析
-
向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
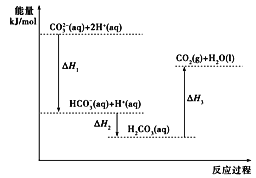
A.反应HCO3- (aq)+H+(aq)=CO2(g)+H2O(l)为放热反应
B.ΔH1>ΔH2 ΔH2<ΔH3
C.CO32- (aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3
D.H2CO3(aq)=CO2(g)+H2O(l) ΔH3<0
难度: 简单查看答案及解析
-
取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份。其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入到500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L。已知Cu2O+2H+═Cu+Cu2++H2O。则稀硝酸的浓度为
A. 2 mol/L-1 B. 1.6 mol/L-1 C. 0.8 mol/L-1 D. 0.4 mol/L-1
难度: 困难查看答案及解析